
|
PDG 发布通则《Q-09:颗粒污染物》重要修订
2025.08.28
8月25日,美国药典(USP)、欧洲药品质量管理局(EDQM)和日本药品和医疗器械管理局(PMDA)均在官网发布了药典讨论组(Pharmacopeial Discussion Group,PDG)正式批准的通则《Q-09:颗粒污染物》(Particulate Contamination)修订版。
此次Q-09通则修订体现了注射剂不溶性微...
|

|
【直播】25年8月全球法规月报划重点
2025.08.28
识林月报直播如期而至,本次直播聚焦8月全球主要监管机构的重点法规,并挑选影响力较大的文件做重点简介。短短40分钟,轻量而轻松,旨在帮助大家回顾上个月的监管重点,加深理解或是查缺补漏。
直播信息速递:
直播时间:9月3日(周三)16点
直播时长:40分钟
直播平台:识林视...
|
|
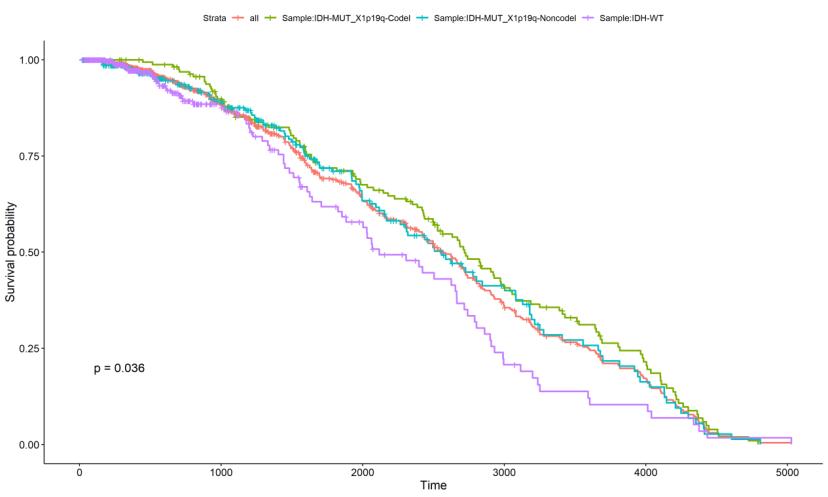
FDA 指南草案深入探讨肿瘤药临床 OS 评估
2025.08.27
8月18日,FDA发布《肿瘤临床试验中总生存期的评估方法》的指南文件草案,征求意见截至10月20日。
总生存期(OS)既是疗效终点,也是安全性终点。一方面,特定药物的治疗效益可能对OS产生积极影响;另一方面,药物的毒性可能对OS产生消极影响。OS是一个客观且具有临床意义的终点,能够...
|
|
EMA 识别5个考量点,拟更新阿尔茨海默病临床指南
2025.08.27
2025年7月14日,EMA发布《关于修订阿尔茨海默病治疗药物临床研究指南的必要性的概念性文件》,文件征求意见截至2026年2月28日。WHO已将痴呆症列为全球公共卫生优先领域,其中阿尔茨海默病(AD)占病例总数的60%-80%。鉴于此,EMA现行指南需纳入AD定义的最新进展,这对所有阶段AD临床...
|
|
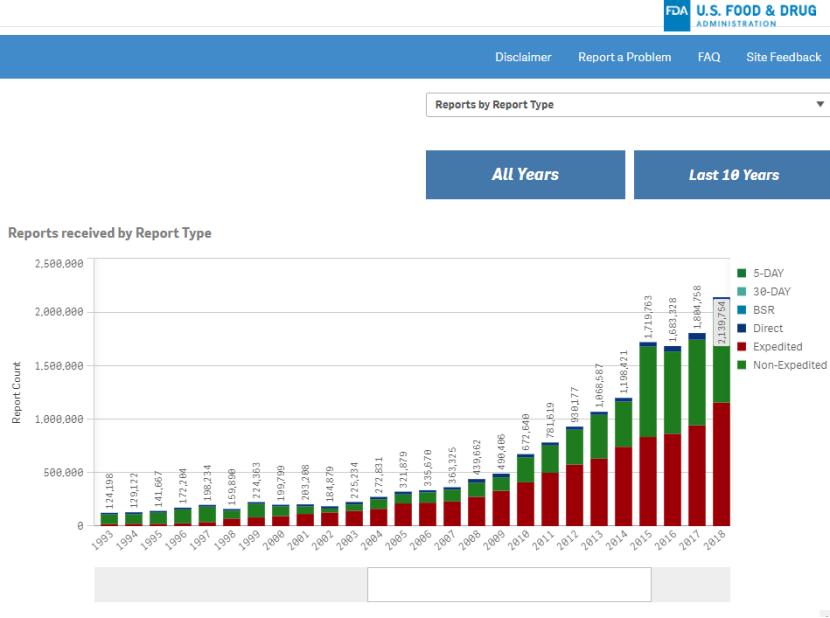
FDA 开始每日更新药品不良事件数据
2025.08.26
FDA于8月22日宣布正式开始每日发布药品及生物制品的不良事件报告。此前,FDA不良事件报告系统(FAERS)每季度更新一次。
FDA局长Marty Makary在声明中表示:“不良事件报告应快速、无缝且透明...那些在政府笨重的(clunky)不良事件报告网站上查找信息的人,不应再等待数月才能看...
|

|
线上讲座:Peter Baker 解读 PICS 和欧盟计算机化...
2025.08.26
今年7月,PIC/S和欧盟同步发布了更新版的附录11《计算机化系统》,细化了全生命周期和基于质量风险管理的数据可靠性要求。同时,美国FDA对中印药企的突击检查(unannounced inspections)不断加大力度,数据可靠性缺陷带来的合规风险日益增加。在这个时机,识林邀请了知名数据可靠性专家、...
|

|
国际药政每周概要:FDA 发现输液袋中亚硝胺,肿瘤药 ...
2025.08.26
【早期开发与临床】
8.18,【FDA】肿瘤临床试验中总生存期的评估方法
8.18,【FDA】肿瘤放射性治疗药物:临床开发期间的剂量优化
8.18,【MHRA】路径 B 重大修改试点
【CMC与仿制药】
8.18,【FDA】关于输液袋中可浸出 NDBA 及其他小分子亚硝胺的最新科学和技...
|

|
研究揭示 FDA 检查结果与药物短缺相关,但结论可能...
2025.08.25
FDA肩负着监管药品供应链质量和短缺风险的双重职责,其最强大的抓手——也是全球药企严阵以待的——是现场检查。现场检查与减少药品短缺之间是否存在关联,乃至是否存在矛盾,一直是行业关注的焦点。近期发表的一篇研究文献《强制回应的 FDA 检查结果和未来的药品短缺》(Obligatory Res...
|

|
诺和诺德收购 Catalent 的美国工厂又收483,因猫毛...
2025.08.25
FDA在7月份对诺和诺德(Novo Nordisk)收购的印第安纳州布卢明顿制药工厂进行检查后发现,该工厂存在猫毛(cat hair)、害虫、细菌以及设备故障等诸多问题,且未对这些问题进行妥善调查。该工厂原属于Catalent,是全球最大的制药合同制造商之一,诺和诺德于去年收购其母公司时一并接手...
|

|
国内药政每周导读:肿瘤药单臂支持常规批准,临床试验...
2025.08.25
【早期开发与临床】
8.20,【CDE】关于公开征求《单臂临床试验用于支持抗肿瘤药物常规上市申请技术指导原则(征求意见稿)》意见的通知
【注册与变更】
8.20,【CDE】关于公开征求《药物临床试验利益相关性声明 (试行) (征求意见稿)》意见的通知
【药物警戒
8.18,...
|

|
【周末杂谈】FDA 在法庭上又跌了一跤
2025.08.24
法院裁定FDA拒批新药申请、又不开听证会的做法是随意和任性的
8月15日,美国联邦上诉法院裁决,FDA拒批Vanda药业治疗时差影响睡眠的新药(tasimelteon)申请、又拒开听证会的做法是随意和任性(arbitrary and capricious)的,命令FDA召开听证会。
六年前,该新药申请遭拒批后,Vand...
|

|
【识林社区】问答集锦16:单次给药毒性试验、欧盟细胞...
2025.08.23
识林社区是面向所有识林用户的互动交流平台。在这里,识林用户提出问题,同时也解答问题,并参与讨论。大家期待的答案,不是一句道听途说,也不仅是“经验之谈”,而且越重要越复杂的问题,往往并无拿来即用的答案。
好的答案,应兼具“依据”、“思考”和“建议”。读者不仅可以有所...
|

|
【识林新文章】全八期药审云课堂问答,ICH GCP 学习...
2025.08.23
在官方法规指南之外,识林或原创、或整理了大量对比解读、案例解析等内容,作为识林用户的参考资料,提供更多视角,与岗位实务联系更为紧密。
这类资料,全部收录在专门为此开发的“对比解读案例解析”数据库内,通过“业务标签”和“知识标签”的交叉索引,用户可迅速查阅学习本岗位最...
|

|
FDA 官方开展的仿制药研究课题概要:复杂 API
2025.08.22
在《2024财年GDUFA科学与研究报告》中,FDA利用内部资源和外部合作,在九大领域开展了超过70项研究课题,涵盖当前仿制药研发、审评以及监管科学的重大课题,旨在全面促进仿制药产品开发和可及。
如今的仿制药开发已不同以往,在质量和成本的双重压力下,我国仿制药企业有必要迎头赶上...
|
|
蔗糖铁仿制药终获 FDA 批准,扫清长达20年的“障碍...
2025.08.22
8月8日,FDA仿制药办公室(OGD)批准了三种蔗糖铁注射液(Iron Sucrose Injection)的简化新药申请(ANDA),认定其与原研Venofer具有治疗等效性。这一事件标志着仿制药行业在补铁剂注射产品领域终于取得突破。
咨询公司Lachman的行业专家Martin Shimer分析称,根据橙皮书信息,Veno...
|

|
FDA 发现输液袋可浸出亚硝胺杂质,要求90天内提交检...
2025.08.21
8月18日,FDA更新了亚硝胺杂质页面,发布一份较为紧急的指南文件。起因是药品审评与研究中心(CDER)注意到,一种小分子亚硝胺杂质N-亚硝基二丁胺(NDBA)已在某些输液袋包装的药品中被检出,存在亚硝胺杂质从印刷外包装或包装袋(printed overwraps or pouches)中浸出或形成的可能...
|

|
2024年 FDA 检查年报:中国设施众多,预期 GMP 检...
2025.08.21
8月份,FDA公布了《2024年设施检查年报》,对2024财年药械设施及检查情况进行了总结。
我国出海企业一贯关注FDA检查。近期出于各种因素,检查有越来越严格的趋势。尽管报告中的数据统计口径不一,且并非直接指导迎检,但宏观数据也有其独特价值。因此识林加以整理并与2023财年报告数...
|

|
Elamipretide 完全回应函分析:临床证据、替代终点和...
2025.08.20
近日,Stealth BioTherapeutics向美媒Pink Sheet全文分享了其严重罕见病巴特综合征(Barth syndrome)药物Elamipretide在5月份被FDA拒批时收到的完全回应函(CRL)。识林曾报道过该药物顺利通过专家咨询会投票,但最终被拒。
尽管此前FDA有计划及时公布CRL,但首批202份只涉及最终...
|

|
新加坡与中国香港药监部门签署合作备忘录
2025.08.20
8月13日,新加坡卫生科学局(Health Sciences Authority,简称HSA)与中国香港特别行政区卫生署(Department of Health,简称DoH)签署了一份关于医疗监管合作的谅解备忘录,标志着双方监管机构在医疗产品监管领域合作的进一步深化。
根据备忘录内容,合作范围涵盖医疗监管领域的...
|

|
FDA 指导药企合理减少临床试验安全数据收集
2025.08.19
7月23日,FDA药品审评与研究中心(CDER)的临床试验创新中心(C3TI)发布白皮书《选择性安全性数据收集》,旨在进一步推动选择性安全数据收集(Selective Safety Data Collection, SSDC)的应用。
SSDC的目的是为开展临床试验的药企减负,简化具有已知良好安全性特征药物的数据...
|