
|
摆脱 MTD 范式,研究呼吁优化肿瘤药剂量选择策略
2025.08.19
ASCO和FDA研究人员在7月发表了题为《证据整体性:肿瘤学剂量选择策略的优化》的文章,呼吁优化抗癌药物开发中的剂量选择策略,提升患者生活质量和治疗效果。
文章指出,传统依赖最大耐受剂量(MTD)的抗癌药物开发策略已不适用于靶向或免疫治疗等新型疗法,此类药物疗效未必随剂量递...
|

|
国际药政每周概要:FDA 终于批准蔗糖铁仿制药,2024...
2025.08.19
【CMC与仿制药】
8.8,【FDA】FDA 回复:请求暂不批准任何 Venofer(蔗糖铁注射液,USP)的仿制版本或其他药学替代品的任何 ANDA 或任何505(b)(2)申请
本周 BE 指南:
【生产质量】
8.1,【FDA】2024年设施检查年报
8.8,【FDA】2024财年药品质量状况报告
8...
|

|
研究揭示 FDA 在印度的“预先通知检查”暗含显著质...
2025.08.18
众所周知,FDA在监管美国本土和印度等国外药品生产设施时,采取不同的通知方式。对内常用突击检查(unannounced),对外则通常会提前数周甚至数月告知检查安排。近日,由杨百翰大学(Brigham Young University)研究人员牵头开展的研究《预先通知的监管检查:FDA监督与药品质量风险》(Pr...
|

|
IPEM 课程 FDA 检查趋势与沟通策略:迎检及483回复...
2025.08.18
FDA近期检查趋势与沟通策略:迎检及483回复实战案例
讲师:Chris Fanelli
时间:9月5-6日
地点:上海
教师简介
Chris Fanelli先生,盛德律师事务所FDA业务团队的GMP/监管合规首席合伙人,曾任FDA合规副首席法律顾问,拥有十多年药品、医疗器械和组合产品的FDA监管与合规经...
|

|
国内药政每周导读:新 CTD 中文征求意见,罕见病药...
2025.08.18
【早期开发与临床】
8.14,【CDE】关于发布《骨关节炎新药临床研发技术指导原则》的通告(2025年第33号)
8.14,【CDE】关于公开征求《药物临床试验中应用贝叶斯外部信息借用方法的指导原则(征求意见稿)》意见的通知
【药学研究】
8.14,【CDE】关于公开征求《罕见病用...
|

|
【周末杂谈】质量风险管理的启发
2025.08.17
若药监局比企业更了解如何管控产品质量,那企业就有问题了
前EU和PIC/S GMP无菌附录修订工作组组长、前英国药监局(MHRA)检查员、现Lachman公司咨询师Andy Hopkins先生最近的博客文:“拥抱质量风险管理原理”(Embracing QMS Principles),颇具启发性。原文请见“lachmanconsultants....
|

|
【轻松一刻】这个客户不审计
2025.08.16
*来自识林向导@眉心映远的实际经历改编。
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们...
|

|
FDA 官方开展的仿制药研究课题概要:杂质
2025.08.15
在《2024财年GDUFA科学与研究报告》中,FDA利用内部资源和外部合作,在九大领域开展了超过70项研究课题,涵盖当前仿制药研发、审评以及监管科学的重大课题,旨在全面促进仿制药产品开发和可及。
如今我国的仿制药市场已不同以往,在质量和成本的双重压力下,我国仿制药企业纷纷迎头赶...
|

|
ICH 新指南草案 Q3E:可提取物与浸出物的控制框架和...
2025.08.15
8月7日,在2020年发布概念性文件并启动指南编写5年之后,ICH发布了《Q3E 可提取物和浸出物指南》(Q3E Guideline for extractables and leachables)草案。药学研究人员最为关心的Q3 杂质系列指南迎来新成员。
CDE的翻译稿想必将很快推出(会员可收藏“中国 ICH 指南官方翻...
|

|
EMA 真实世界研究报告反映欧洲监管策略卓有成效
2025.08.14
近年来,真实世界数据(RWD)/真实世界证据(RWE)在医药监管中的作用日益凸显。欧洲药品管理局(EMA)近期发布的报告显示,在2024年2月至2025年2月间,相关研究数量增长了47.5%,达到59项(33项已完成,26项正在进行中)。这一进展不仅体现了EMA在数据整合能力上的提升,也为全球RWD/...
|
|
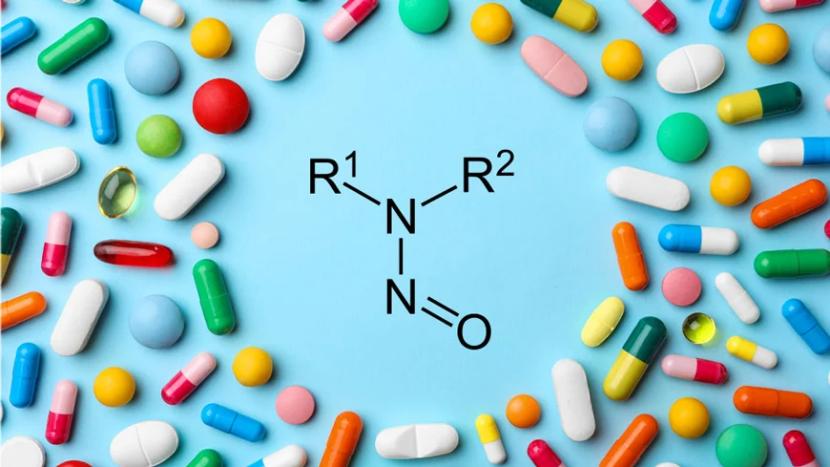
EMA 全面阐述欧盟亚硝胺监管,接下来期待新 M7 附...
2025.08.14
在7月29发布的《人用药中的亚硝胺杂质 - 欧洲药品监管网络的应对》中,EMA全面回顾了欧盟药品监管网络(EMRN)针对亚硝胺杂质的监管历程。
从2018年的“缬沙坦”事件到现在,亚硝胺已成全球监管热点,从源头控制、过程质控到终产品限度控制,中美欧的监管方式大同小异,且互为补充...
|

|
FDA 发布2024财年药品质量状况报告,中印是检查焦点
2025.08.13
近日,FDA药品质量办公室(OPQ)发布了2024财年药品质量状况报告,分享了生产场地分布、药品类型数据、警告信和进口禁令等信息。
报告显示,FDA的全球药品生产场地目录中共有 4619 个生产场地,较过去五年增长 11%。其中,41% 的场地位于美国境内,其次是印度与中国。场地数量增...
|

|
FDA 分析过去七年 GCP 检查,揭示临床试验合规现状
2025.08.13
FDA研究人员在7月份发表了一项针对2017至2023年间GCP检查的深度分析结果,显示合规率稳步提升,试验方案依从性成首要缺陷。
研究聚焦于支持新药申请(NDA)、生物制品许可申请(BLA)及紧急使用授权(EUA)的常规GCP检查,共涵盖2836次对临床研究者(CI,85.9%)、申办方(9.7%)...
|

|
欧洲药典12.1版本更新内容概要
2025.08.12
欧洲药典(Ph. Eur.)将每年更新一版(曾经是三年一版),当前版本为Ph. Eur. 12,且每年发布3版增补(issue),7月份更新至12.1。
拟修订或新增的药品标准草案会先在欧洲药典论坛(Pharmeuropa)发布征求意见,随后由欧洲药品质量管理局(EDQM)和药典委员会(EPC)根据反馈意...
|
|
2015 - 2024年欧美日等六家监管机构新药批准趋势简...
2025.08.12
近日,国际组织监管科学创新中心(Centre for Innovation in Regulatory Science, CIRS)发布了其年度分析报告,聚焦于2015至2024年间EMA、FDA、日本药品和医疗器械管理局(Pharmaceuticals and Medical Devices Agency, PMDA)、加拿大卫生部(Health Canada,HC)、瑞士医药管理局...
|

|
国际药政每周概要:ICH 可提取物和浸出物指南,FDA ...
2025.08.12
【早期开发与临床】
8.6,【EMA】关于修订阿尔茨海默病治疗药物临床研究指南的必要性的概念性文件
【药学研究与CMC】
8.7,【ICH】Q3E 可提取物和浸出物指南
本周 BE 指南:
【注册审评】
8.6,【FDA】MAPP 5017.1 Rev. 1 药品质量评估办公室 III 与药品生...
|

|
“离职”10天,Prasad 重返 FDA 担任 CBER 主任
2025.08.11
当地时间8月9日,美国卫生部(HHS)发言人向美媒确认,Vinay Prasad医学博士在7月29日离职约10天后回归FDA,仍然担任生物制品审评与研究中心(Center for Biologics Evaluation and Research,CBER)主任一职。
Prasad的离职原因一直未明确,但据称与保守派人士的施压密切相关。...
|

|
FDA 推出新计划“PreCheck”为美国药厂“回流”开绿...
2025.08.11
8月7日,FDA宣布启动一项名为“PreCheck”(“预先确认”)的新计划,旨在通过简化流程、提前介入、加强沟通以及高效的化学、生产和控制(CMC)评估,加快美国国内药品制造基地的建设。
今年 5 月,特朗普签署行政命令要求FDA在 180 天内审查国内药品生产的指南,并改善对美国设...
|

|
国内药政每周导读:重组胰岛素药学,药品包装规格指南...
2025.08.11
【药学研究】
8.5,【CDE】关于公开征求《重组胰岛素类产品药学研究与评价技术指导原则(修订版征求意见稿)》意见的通知
8.8,【药典会】关于0982 粒度和粒度分布测定法第三法光散射法标准草案的公示
【注册与变更】
8.5,【CDE】关于公开征求《关于开发适宜药品包装规...
|

|
【周末杂谈】企业勇于创新,FDA 秉公执法
2025.08.10
基于对作用机理的科学认知和监管审批的公正把握,治疗老花眼的新药得以面世
十天前,FDA批准了来自美国加利福尼亚州圣地亚哥市LENZ Therapeutics制药公司治疗老花眼的创新眼药水Vizz。该药靠的不是调整眼球的焦距,而是缩小瞳孔的有效孔径,来改进视力。
对老花眼的认知和治疗,由来...
|