
|
国际药政每周概要:ICH E20 临床适应性设计,FDA ...
2025.07.02
【早期开发与临床】
6.24,【FDA】以游走性红斑为表现的早期莱姆病:开发治疗药物
6.25,【MHRA】药物临床试验:通知类(notifiable)临床试验
6.25,【ICH】E20 临床试验适应性设计
6.26,【FDA】存在未满足医疗需求的严重细菌性疾病患者的抗菌治疗 - 问答
【生产质量】...
|

|
BIO 2025上的不确定性:监管变革,药价承压和资源削...
2025.07.01
2025年6月16日至19日,生物技术创新组织(BIO)在波士顿迎举办2025年度BIO国际大会(BIO International Convention)。大会为期四天,涵盖超过180场会议和1100名演讲者,涉及20个重点领域,包括人工智能和数字健康、下一代生物治疗、商业发展等。参与者包括领先的生物技术公司、投资者...
|
|
不赚钱也得有路可走,Woodcock 谈仿制药老药新用监管...
2025.07.01
近日,Duke Margolis健康政策研究所举办了一场研讨会,来自非营利组织(NPO)人员以及一位业界十分熟悉且广受尊敬的前FDA高官Janet Woodcock齐聚一堂,共同探讨了如何激励NPO基于现有仿制药开发老药新用(repurposing)。
与会者称,尽管目前有4000种疾病已经有相应的治疗药物,但仍有1...
|

|
不决策,人工去幻觉,离线缺训练:FDA 的 Elsa 仍...
2025.06.30
6月份,在DIA年会,FDA首席AI官Jeremy Walsh和数据科学与AI政策副主任Tala Fakhouri均谈及了刚刚在6月初发布的FDA内部AI工具Elsa,对业界的诸多疑问进行了不同程度的回应。近期发布的一篇针对AI用于审评的FDA研究文献也提供了一些参考信息。但Elsa的面目对于业界来说仍不明朗。此外,FD...
|

|
专家会5:4投票反对,FDA 批准膀胱癌新药 Zusduri
2025.06.30
6月12日,FDA批准了UroGen Pharma公司的丝裂霉素膀胱内灌注液产品Zusduri,用于治疗复发性低级别中危非肌层浸润性膀胱癌(LG-IR-NMIBC)成人患者。而在一个月前,肿瘤药专家咨询委员会以54的投票结果反对该药的批准。
Zusduri是一种改良剂型的丝裂霉素产品,通过水凝胶技术实现更...
|

|
国内药政每周导读:医保法征求意见
2025.06.30
【监管综合】
6.27,【国家医疗保障局】医疗保障法(草案)征求意见
【新药批准和报产】
6.23-6.29,NMPA未发布新药批准,CDE受理4个新药上市申请
【监管综合】
6.27,【国家医疗保障局】医疗保障法(草案)征求意见
在中华人民共和国境内从事医疗保障相关的...
|

|
【周末杂谈】FDA 的监管信息化,总算要做点实事了?
2025.06.29
参众两院两党联合提案,授权FDA信息化监管标签和说明书
本专栏已有一段时间不怎么谈及美国FDA了,因为实在是觉得没啥可说的。待FDA内部整顿完毕,明确了下一步的监管政策,且若有值得国内药企或药监关注的内容,再讨论不迟。
今天讨论的事,不是出于FDA自身的所作所为(至少表面上不是...
|
|
FDA 延长亚硝胺相关杂质限度实施提交期限
2025.06.27
6月23日,FDA在其“亚硝胺杂质可接受摄入量限度”页面上发布消息,鉴于药企在应对亚硝胺药物成分相关杂质(NDSRIs)限度实施工作时面临挑战,决定延长提交的期限,为药企提供了更充裕的时间来完善相关限度实施与控制策略。
亚硝胺类杂质问题最早可追溯至2018年,当时在缬沙坦(valsart...
|

|
2024财年 GDUFA 报告:856个 ANDA 获批,解除警告信...
2025.06.27
6月13日,FDA发布了《2024财年 GDUFA 绩效报告》(GDUFA,仿制药使用者付费修正案),详细展示上个财年仿制药审批及相关领域的工作成果。
出于对GDUFA收取费用的承诺,FDA每年都要发布绩效报告,以向立法者和业界证明费用收支的合理性。报告中有关批准数据、审评审批时限达成率以及...
|

|
线上讲座:FDA 近期趋势对中国药业的影响——人员机...
2025.06.26
FDA近期的系列变化对中国药业有重大影响。例如,FDA正在大力推动制药回归美国,同时加紧对海外工厂的监管力度。5月5日,FDA美国总统特朗普签署了要求 FDA “内松外紧”的“促进国内关键药品生产的监管减负”(Regulatory Relief to Promote Domestic Production of Critical Medicin...
|

|
众议院拨款委员会对 FDA 提出的几点要求
2025.06.26
众议院拨款委员会2026财年FDA拨款案已经投票表决通过,将为FDA提供66.8亿美元的拨款。FDA将获得32亿美元的预算授权,比目前的资金水平减少3.757亿美元,即10.5%,但比特朗普政府的要求多出3310万美元。使用者付费总额将达到34.8亿美元。
众议院拨款委员会同时发布的一份报告中反...
|

|
【直播】25年6月全球法规月报划重点
2025.06.26
识林月报直播如期而至,本次直播聚焦6月全球主要监管机构的重点法规,并挑选影响力较大的文件做重点简介。短短40分钟,轻量而轻松,旨在帮助大家回顾上个月的监管重点,加深理解或是查缺补漏。
直播信息速递:
直播时间:7月3日(周四)20点
直播时长:40分钟
直播平台:识林视...
|
|
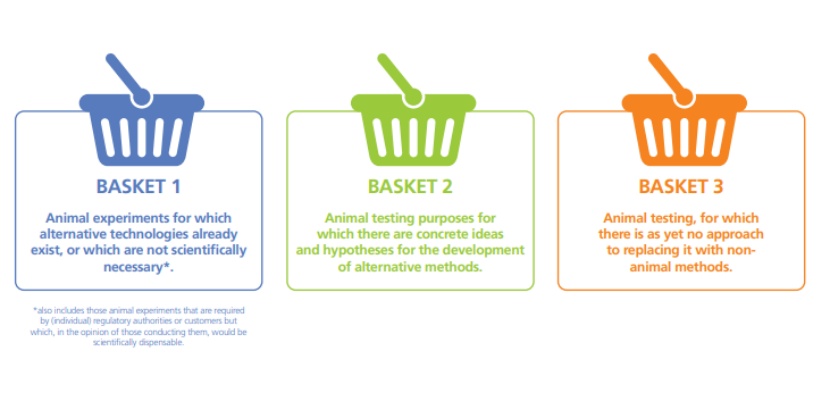
EFPIA 提出“三篮子”计划:加速淘汰动物实验
2025.06.25
6月12日,欧洲制药工业协会联合会(EFPIA)发布报告,提出一项创新的“三篮子”(3 Baskets)计划,旨在系统性地推动制药行业淘汰(phasing out)动物实验,并逐步引入新型替代方法(NAM)和非动物技术(NAT)。
报告指出,相比其他行业,出于权衡安全性和有效性的必要,制药行业在...
|

|
欧盟拟立法促进欧洲生物技术竞争力
2025.06.25
5月14日,欧盟委员会发布了一份“证据征集”(Call for Evidence)文件,系统性反省欧洲生物技术产业在多个领域面临的挑战与机遇,其目的在于制定一份《欧洲生物技术法案》(European Biotech Act),旨在通过立法手段,推动生物技术从实验室走向市场,提升欧洲在全球生物技术领域的...
|

|
FDA 拟审查美国人细胞出口到“敌对国家”处理用于临...
2025.06.24
6月18日,FDA宣布立即审查涉及将美国公民的活细胞送往“中国及其他敌对国家”(China and other hostile countries)实验室进行基因工程处理,并重新输注回美国患者的临床试验。
FDA声称,部分试验未能充分告知参与者其生物材料将被送往海外进行处理,甚至在某些情况下,患者对这...
|

|
药企出患者进,FDA 招募消费者代表加入专家咨询委员...
2025.06.24
6月13日,FDA在联邦通告(Federal Register)发布通知,正式开启消费者(Consumer)代表招募程序,向个人及消费者组织提供多个药品专家咨询委员会(Advisory Committees,以下简称AC会)和医疗器械专家组(Panel)的投票或非投票席位。
消费者代表需代表消费者观点,且作为AC会与消...
|

|
国际药政每周概要:FDA 局长优先审评券,叫停国外编...
2025.06.24
【早期开发与临床】
6.16,【EMA】关于非临床数据交换标准(SEND)概念验证的行业问答
6.18,【EMA】关于系统性硬化症治疗药物临床研究的新思考性文件的概念性文件
【药学研究与CMC】
6.16,【EMA】更新生物制品问答
【注册审评】
6.13,【FDA】征集个人及消费者组...
|

|
国内药政每周导读:创新药30天批临床,IND 申报资料...
2025.06.23
【早期研究与临床】
6.19,【CDE】关于公开征求《带状疱疹疫苗临床研究技术指导原则(征求意见稿)》意见的通知
6.20,【CDE】关于公开征求 ICH《E21:临床试验中纳入妊娠和哺乳期女性》指导原则草案意见的通知
6.20,【CFDI】关于发布《药物Ⅰ期临床试验管理指导原则》的通告
...
|
|
FDA 定稿仿制药“警告信后会议”指南,详述 CAPA ...
2025.06.23
6月18日,FDA定稿了《GDUFA下的警告信后会议》。该指南曾于2023年8月征求意见,旨在为仿制药企业提供在收到警告信后与FDA进行有效沟通和整改的详细流程和要求。
《仿制药使用者付费修正案》(Generic Drug User Fee Amendments,简称GDUFA)是FDA与仿制药行业协商达成的一项协议...
|

|
现场研学课 基于欧盟-PICS 无菌附录的合规实践与模...
2025.06.23
为帮助企业提升无菌生产合规实践,风险识别管控及迎检能力,IPEM将开设系列现场研学课。下周开设第一期,重点围绕国内GMP监管体系下的无菌生产合规实践与模拟审计。两周后的7月5-7日(周六-周一)在杭州澳亚生物,我们将切换视角,从欧盟-PIC/S无菌GMP检查专家的视角,带领学员学习无菌GM...
|