|
FDA 定稿仿制药“警告信后会议”指南,详述 CAPA ...
2025.06.23
6月18日,FDA定稿了《GDUFA下的警告信后会议》。该指南曾于2023年8月征求意见,旨在为仿制药企业提供在收到警告信后与FDA进行有效沟通和整改的详细流程和要求。
《仿制药使用者付费修正案》(Generic Drug User Fee Amendments,简称GDUFA)是FDA与仿制药行业协商达成的一项协议...
|

|
现场研学课 基于欧盟-PICS 无菌附录的合规实践与模...
2025.06.23
为帮助企业提升无菌生产合规实践,风险识别管控及迎检能力,IPEM将开设系列现场研学课。下周开设第一期,重点围绕国内GMP监管体系下的无菌生产合规实践与模拟审计。两周后的7月5-7日(周六-周一)在杭州澳亚生物,我们将切换视角,从欧盟-PIC/S无菌GMP检查专家的视角,带领学员学习无菌GM...
|

|
【周末杂谈】就这个价,还想要美国造?
2025.06.22
规模仿制药公司,几乎都没有制造回归美国的计划
多年前,参观一家专做冻干委托生产的国内工厂时,发现西林瓶内不是均匀的白粉,而是掺杂着一些大小不等的白色斑块。老板不屑一顾地说:“出这个钱,就只能做到这样”,让笔者肃然起敬。为何,因为老板实话实说。遗憾的是,这只是朋友间的私...
|
|
【识林FAQ】“识林是谁?”大家怎么说,您又怎么看?
2025.06.21
识林将经常被大家问到的一些问题归纳起来,整理出一份FAQ(常见问答),共计18个问题,涵盖识林的功能定位、知识内容、差异化特点、使用方法、平台价值等等主题。这些问题的解答需要识林与用户之间的双向沟通,而不是单方面的自说自话。于是,我们把问题都放在了社区。对于每个问题,“@...
|

|
阿尔茨海默病2025研发管线速览
2025.06.20
阿尔茨海默病(Alzheimer's Disease,AD)始终是医学领域最棘手的挑战之一。1995-2021年间,用于AD研究的私有资金高达425亿美元,但 140 多项试验都未能研制出一种能够减缓该病的药物。数十年以来积累的极高失败率使得AD形成了研发黑洞的基本印象,然而,管线趋势的改变可能会逐步...
|
|
最快1-2月获批,FDA 推出“国家优先审评券”
2025.06.19
6月17日,FDA局长Martin Makary宣布一项名为“国家优先审评券”(Commissioner's National Priority Voucher, CNPV)的试点计划,旨在通过创新的审评模式,大幅缩短药品审评时间。
FDA局长将决定哪些领域属于“国家优先”,并据此选择有资格获得CNPV的药品。所谓“国家优先”,按...
|

|
FDA 局长在 DIA:加速审批,大数据实时监测新药,通...
2025.06.19
6月16日,在DIA 2025全球年会上,FDA局长Martin Makary在发言中阐述一系列变革举措,包括通过利用电子健康记录对上市药物实施监测、开辟新的审批路径、加强与行业的沟通以及扩大真实世界数据(RWD)的应用,并展望未来五年FDA在通用流感疫苗、细胞和基因治疗以及创伤后应激障碍(PTSD...
|
|
EMA 拟认定 PBPK 建模平台 Simcyp,可预测药物相...
2025.06.18
5月7日,欧洲药品管理局(EMA)发布其下属的人用药品委员会(CHMP)对Simcyp 模拟器(Simcyp Simulator)V19R1(以下简称Simcyp V19)的认证意见草案。EMA允许企业按照使用场景(CoU)以及良好实践建议将Simcyp V19用于新药的药物相互作用(DDI)风险评估,此时可在注册申报中引用该...
|

|
国际药监联盟 IPRP 马德里会:继续推动全球监管协调
2025.06.18
5月14日至15日,国际药品监管机构计划(IPRP)管理委员会第15次会议在西班牙马德里举行。可能是考虑到与会监管机构的方便,该会议选择与ICH马德里大会在同一城市的相近时间举行。
此次会议汇聚了来自全球的31个IPRP成员和观察员,共同探讨药品监管领域的最新进展和未来发展方向,并展示...
|

|
EMA 2024年报:新药批准,真实世界与人工智能
2025.06.17
6月10日,欧洲药品管理局(EMA)发布了2024年报,详尽阐述过去一年的工作与成就。浏览年报可见,除了必不可少地宣示自己在新药审评方面成就斐然,EMA还单独辟出板块介绍真实世界数据应用与人工智能,昭示着其接下来的监管科学发展导向。
现将这三个部分的要点总结如下。也可阅读报告...
|
|
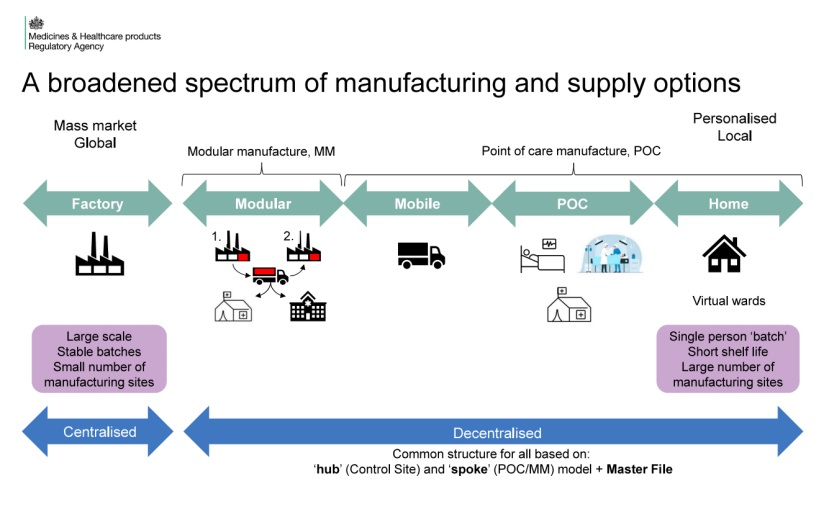
MHRA 发布7份系列指南,支持全球首个去中心化制造监...
2025.06.17
6月11日,英国药品和健康产品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)宣布,为即将于7月23日生效的全球首个去中心化制造(Decentralized Manufacturing,DM,曾译为分散式制造,现参考我国官方对去中心化临床的翻译)框架,发布了七份指南文件,涵盖...
|

|
国际药政每周概要:MHRA 发7份去中心化制造指南,FDA...
2025.06.17
【早期开发与临床】
6.12,【EMA】HMA-EMA 真实世界数据来源和研究目录的用户指南
【注册审评】
6.10,【EMA】根据法规(EC)726/2004条款57(2)引入的法律要求提交的药品数据的质量控制
6.12,【EDQM】CEP 认证程序行为准则
6.13,【FDA】ANDA:与优先仿制药申报相...
|

|
现场研学课 接轨 PICS 对我国药业 GMP 实践的影...
2025.06.16
随着我国加入PIC/S的进程持续推进,药监部门在积极强化检查能力和体系建设,《无菌药品附录(征求意见稿)》也已发布。建立与PIC/S接轨、具有国际竞争力的生产质量体系,既是国际化药企开拓全球市场的必备条件,也是本土药企在激烈竞争中求生和发展的核心需求。
6月23-25日,在杭州,IP...
|
|
Sarepta 基因治疗载体获首个 FDA “平台技术”认定
2025.06.16
6月4日,Sarepta Therapeutics宣布其基因治疗载体获得FDA的“平台技术(Platform Technology)”认定。
基因治疗药物研发和上市过程面临着诸多挑战,其中一个关键问题是,实验性治疗往往共享某些组分,如用于递送治疗基因的病毒载体。这些组分的安全性和有效性需要在每个单独的治疗...
|

|
国内药政每周导读:化药药学变更管理方案,先进治疗药...
2025.06.16
【注册与变更】
6.9,【CDE】关于公开征求《化学药品批准后药学变更管理方案技术指导原则(征求意见稿)》意见的通知
6.11,【CDE】常见一般性技术问题解答 - 新增1个问答
【监管综合】
6.9, 【国务院】关于进一步保障和改善民生 着力解决群众急难愁盼的意见
6.10...
|

|
【周末杂谈】大模型推理的局限性
2025.06.15
LLM和LRM随着任务复杂度的增加,会完全丧失推理能力
十天前,苹果公司的研发团队发布了一篇AI研究论文。不愧是出自苹果之手,无论是新颖的方法论,让人意想不到的结果和结论,还是论文写作的精炼和插图的精美,都令人耳目一新。
笔者非AI专家,难以专业地对论文说三道四。下面只是对论...
|

|
【识林新文章】第6期药审云课堂问答,化药受理要点,F...
2025.06.14
在官方法规指南之外,识林或原创、或整理了大量对比解读、案例解析等内容,作为识林用户的参考资料,提供更多视角,与岗位实务联系更为紧密。
这类资料,全部收录在专门为此开发的“对比解读案例解析”数据库内,通过“业务标签”和“知识标签”的交叉索引,用户可迅速查阅学习本岗位最...
|
|
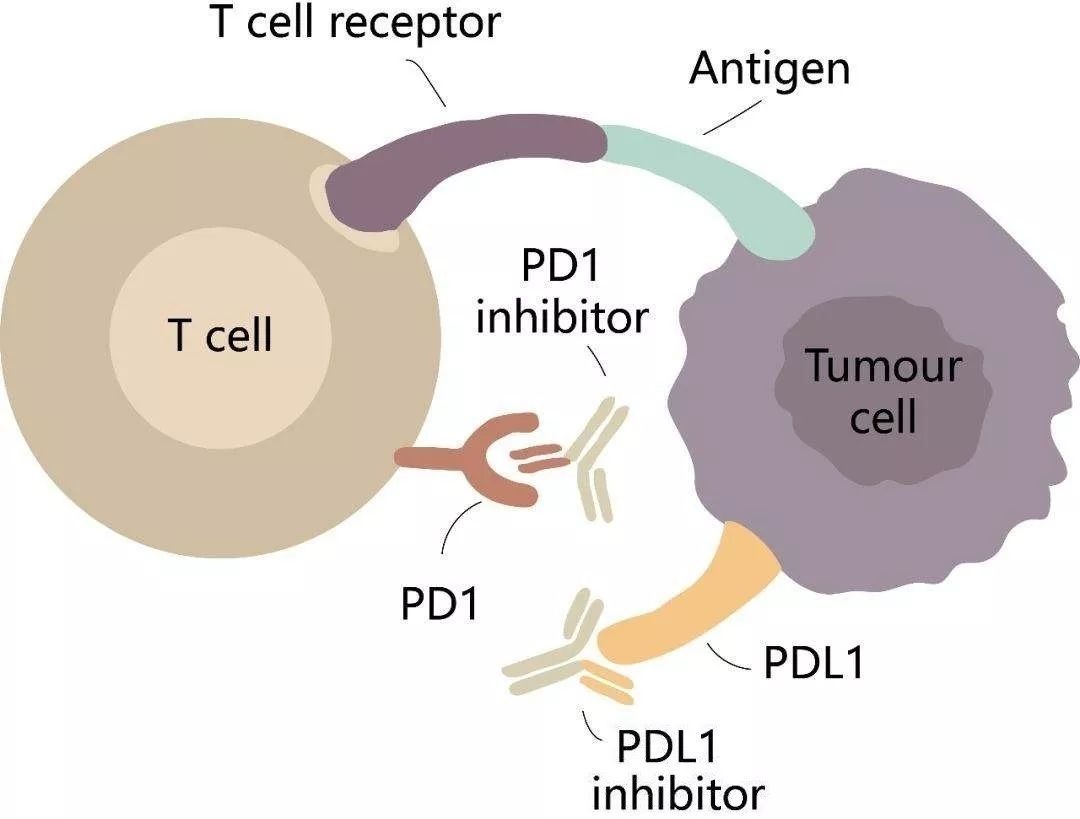
FDA 调整 K 药 O 药胃癌和食管癌适应症,限于 PD...
2025.06.13
FDA于2025年5月22日和23日分别向默克(Merck)和百时美施贵宝(Bristol Myers Squibb,BMS)发出信函,要求调整其药物的适应症标签。调整后的适应症明确Keytruda(帕博利珠单抗)和Opdivo(纳武利尤单抗)仅适用于PD-L1阳性的转移性胃癌、胃食管结合部(GEJ)癌和食管癌患者。这意味...
|
|
EMA 将严重眼部疾病定性为司美格鲁肽“非常罕见”的...
2025.06.13
6月6日,EMA宣布,诺和诺德(Novo Nordisk)的司美格鲁肽产品Ozempic、Rybelsus和Wegovy的产品信息需要更新,以将一种严重眼部疾病列为“非常罕见”的副作用。
司美格鲁肽是一种GLP-1受体激动剂,被广泛用于治疗2型糖尿病和减重,市场表现极佳。近年来,多项研究探讨了GLP-1类药物...
|

|
【全文翻译】 FDA 局长文章《新 FDA 的优先事项》
2025.06.12
6月10日,FDA局长Makary(与新任CBER主任Prasad共同署名)在《美国医学会杂志》(JAMA)发表题为《新FDA的优先事项》(Priorities for a New FDA)的文章,第一次全面而系统地阐述自己的“施政纲领”。
自特朗普再次上台以来,FDA几乎一直处于预算削减人员裁撤、管理方式大幅转变...
|