
|
FDA 拟将药品着色剂上市后变更降为中等
2025.06.12
5月29日FDA发布了针对药品着色剂变更的草案指南。一般情况下,此类变更现将被视为中等变更,提交“30天内生效变更”(Changes Being Effected in 30 days,CBE-30)即可。
早在1997年2月发布的《速释制剂扩大规模或上市后变更指导原则有关事项的问题和解答》(SUPAC-IR Questions an...
|

|
哈佛报告示警,五大新兴技术中,中国生物技术最接近超...
2025.06.11
6月5日,哈佛大学贝尔弗科学与国际事务中心(Harvard Belfer Center for Science and International Affairs)发布了一份全球技术地缘政治文件《关键新兴技术指数报告》(Critical and Emerging Technologies Index)。报告指出,在人工智能、生物技术、半导体、航天和量子技...
|

|
取消兔热原检测后怎么办?EMA 发布相关问答
2025.06.11
5月27日,EMA近期更新了药品质量问答,新增了对取消兔热原检测(家兔法)后变更管理的建议。
欧洲药典取消兔热原检测方法
EMA在2025年2月发布了一份思考性文件,阐述了欧洲药典和人用药委员会不同工作组(如非临床工作组、疫苗工作组等)对替代、减少和优化(3R)原则实施的思考,...
|

|
FDA 圆桌会探讨放宽 CGT 监管,“中国”字眼屡被提...
2025.06.10
6 月 5 日,在FDA举办的细胞和基因治疗(CGT)圆桌会议上,多位行业专家呼吁 FDA 放宽对基因治疗早期临床试验的监管,以确保美国在该领域的创新优势不被中国超越。
虽是FDA组织的会议,且议题原本仅限于CGT,但包括卫生部长小肯尼迪,美国国立卫生研究院(NIH)主任Bhattacharya...
|
|
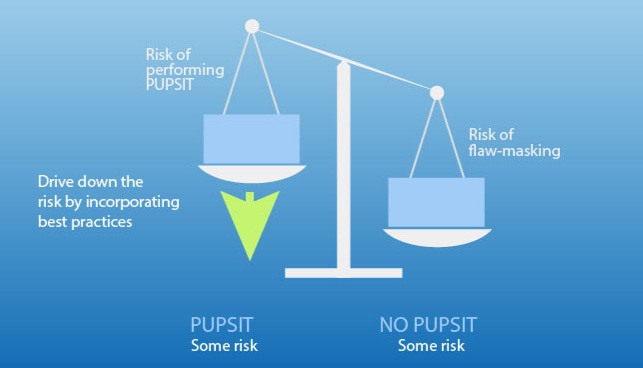
BPOG 发布问答文件指导 PUPSIT 实施
2025.06.10
4月,BPOG发布了一份题为《解读附录1:关于除菌过滤的见解 - 常见问题》(Navigating Annex 1 Sterile filtration insights FAQs)的文件,以问答形式总结了其团队在2023年和2024年会议中最常讨论的要点。其中多个问答针对PUPSIT(pre-use post sterilisation integrity te...
|

|
国际药政每周概要:FDA 发布 AI 工具 Elsa ,非...
2025.06.10
【早期开发与临床】
6.4,【EMA】皮下和/或肌肉注射用普通人免疫球蛋白(SCIg/IMIg)的临床研究指南
6.6,【PMDA】抗微生物药耐药的革兰氏阴性细菌感染治疗药物临床开发需考虑的要点(早期考虑)
【注册审评】
6.4,【FDA】符合“关于微小变更的非处方药专论程序 C001:某...
|

|
FDA 审评考量与申报路径选择:Elamipretide 案例的...
2025.06.09
5月29日,FDA向Stealth Biotherapeutics公司发出了关于其巴特综合征(Barth syndrome)治疗药物Elamipretide的完全回应函(Complete Response Letter,CRL),拒绝其新药申请(NDA)。此前在2024年咨询委员会上,专家以10-6的投票结果认为Elamipretide的疗效已经得到证明。更早之前的2...
|

|
IPEM课程 分析方法在生物制药和质量控制上的应用
2025.06.09
分析方法在生物制药和质量控制上的应用
授课老师:郭允籣
上课日期:6月21-22日(周六 - 日)
授课方式:中文
上课教室:上海
老师简介
郭允籣,现任信达生物全球R&D运营负责人,有25年以上从事蛋白分析科学与质量研究的丰富经验。曾先后在美国Amgen、Abbott和Gen...
|

|
国内药政每周导读:质量安全内部举报人奖励制度落地
2025.06.09
【监管综合】
6.5,【NMPA】关于对药品医疗器械质量安全内部举报人举报实施奖励的公告(2025年第41号)
【新药批准和报产】
6.2-6.8,NMPA发布19个新药批准,CDE受理10个新药上市申请
【监管综合】
6.5,【NMPA】关于对药品医疗器械质量安全内部举报人举报实施奖励的公...
|

|
【周末杂谈】Benford定律识别数据可靠性?
2025.06.08
自然产生的数据与人为改动后的数据有统计特性差异
最近听朋友说他们正在用AI来帮助药企和药监部门识别数据可靠性问题。严格讲来,AI是统称,涵括很多内容,例如:最近时兴的大语言模型,及传统的机器学习,都是AI。其实,对很多非专业人士来说,自动化也是某种程度上的AI。若是能自动地识...
|
|
【识林新功能】AI 陪您一起“听”课
2025.06.07
识林升级版用户可学习57个模块的800+门课程5000+节视频,涵盖药品研发、注册、生产、质量等全生命周期,包括IPEM部分精华课程,监管和学术机构专题教学和研讨,以及各类专业实操。
正如精读一篇法规或文献,专注一堂课也很耗费精力。AI凭借其长文本处理能力,结合课件和字幕,能迅速总...
|

|
【轻松一刻】大脑里的套路
2025.06.07
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转化为漫画,在识林平台上分享给大家。
...
|

|
CIOMS 发布196页药品风险获益研究报告,全景展现科学...
2025.06.06
5月,国际医学科学组织委员会(CIOMS)在日内瓦发布了《药品风险获益平衡:CIOMS第十二工作组报告》。这份报告更新了1998年CIOMS第四工作组的旧版报告,在药品全生命周期的风险获益评估(Benefit-Risk Assessment,BRA)中引入了诸多创新理念与方法,为制药企业和监管机构提供了极具价...
|

|
【转载】关于举办第八届中国药品监管科学大会的通知
2025.06.06
各有关单位:
第八届中国药品监管科学大会定于6月13日—15日在北京召开。大会将以习近平新时代中国特色社会主义思想为指引,全面贯彻落实党的二十大和二十届二中、三中全会精神,围绕国办53号文件的总体要求,按照全国药品监督管理工作会议部署,注重前沿议题、推动原创成果、提升组织能...
|

|
药企履行上市后要求和承诺吗?看 FDA 最新年报
2025.06.05
5月30日,FDA发布了《2023财年药品和生物制品公司在执行上市后要求和承诺方面的绩效报告》,评估药企在产品获批后履行相关研究和临床试验要求及承诺的情况。
这包括上市后要求(PMR)和承诺(PMC)。前者是根据法规要求必须开展的研究或临床试验;后者则是申请人自愿承诺且书面同意开...
|

|
FDA 因 CMC 数据不足拒收 Savara 罕见肺病药物申...
2025.06.05
FDA于5月27日拒绝了Savara公司针对其罕见肺病药物Molbreevi的申请,原因是化学、生产和控制(CMC)数据不足。Savara的股票($SVRA)在周二下跌了31%。
Molbreevi是用于治疗一种罕见的自身免疫性肺泡蛋白沉积症(autoimmune pulmonary alveolar proteinosis,aPAP)的药物。Savara...
|
|
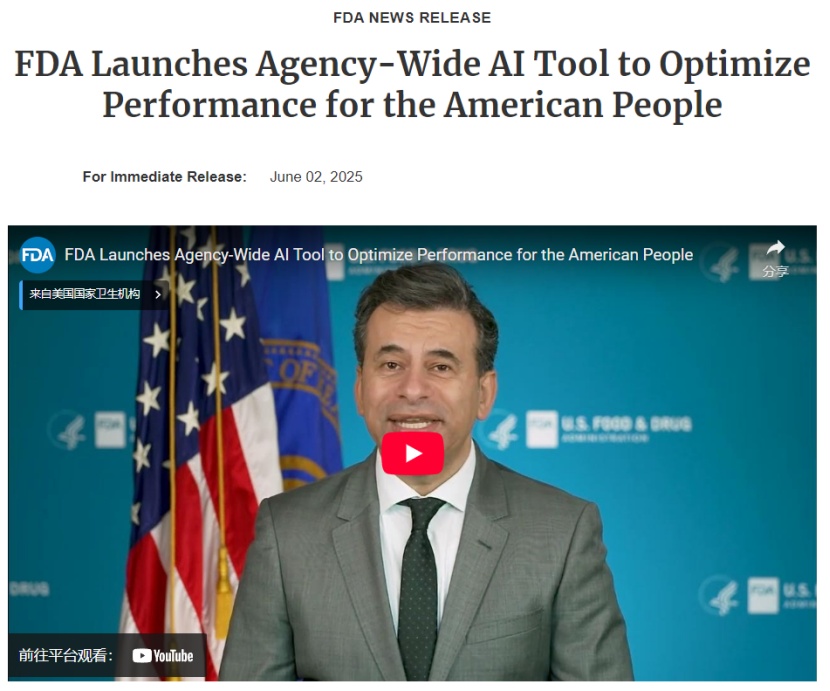
FDA 发布人工智能 Elsa,大幅提前,质疑依旧
2025.06.04
6月2日,FDA正式发布Elsa,一款生成式人工智能(AI)工具,旨在助力从科学审评人员到检查人员的工作效率提升。
据FDA新闻稿称,Elsa的核心功能包括阅读、写作和总结。在实际应用中,它能够对不良事件进行总结,以支持安全性评估;快速进行标签比较;生成代码,帮助开发用于非临床应用...
|
|
EMA 拟起草胃肠道药物相互作用指南,填补 ICH M12...
2025.06.04
5月23日,欧洲药品管理局(EMA)发布了《关于胃肠道内药物相互作用研究的指南的概念文件》,旨在填补 ICH M12 指南未涵盖的胃肠道药物相互作用(DDI)研究领域的监管空白。
ICH的 M12 《药物相互作用研究》指南于 2024 年 11 月 30 日生效,正式取代了自 2013 年 1 月 1...
|

|
国际药政每周概要:FDA 报告上市后研究进展,色素变...
2025.06.04
【药学研究与仿制药】
5.28,【FDA】CDER 亚硝胺杂质可接受摄入量限度更新
本周BE指南:
【注册审评】
5.29,【FDA】替换已批准或已上市药品中的色素添加剂
【生产质量】
5.27,【EMA】药品质量问答:第一部分更新:逐步取消兔热原检测问答
本周483和警告信
【监管综合...
|
|
欧盟追踪去中心化临床试验,加速推广 DCT
2025.06.03
近日,欧盟药品监管网络(European Medicines Regulatory Network, EMRN)宣布将在欧盟临床试验信息系统(Clinical Trials Information System, CTIS)中引入一个结构化数据字段,以监测去中心化临床试验(Decentralized Clinical Trials, DCT)的使用情况,目的是通过收...
|