
|
【轻松一刻】所有的坑都要避吗?
2025.05.03
参考:PMBOK-6th edition
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转...
|
|
季度财报后,跨国药企纷纷表态“回归”美国
2025.05.02
随着制药行业对药品关税的紧张情绪不断升温,跨国药企们顺势而为。继礼来(Eli Lily)投资270亿美元建厂、强生(Johnson & Johnson)规划5年投资550亿美元之后,阿斯利康(AstraZeneca)、诺华(Novartis)、默克(Merck)也在公开季度财报之后纷纷宣布将通过所谓“美国本土生产”(US ...
|

|
FDA 招募第二轮药品质量管理成熟度试点企业
2025.05.01
FDA药品评价与研究中心(CDER)于4月23日发布通知,将继续开展药品质量管理成熟度(质量管理成熟度,QMM)原型评估协议项目。该项目旨在通过改进和完善评估工具,帮助药品生产企业提升质量管理水平,确保药品供应链的稳定性和可靠性。可以看出QMM项目仍在按部就班进行,并未受到近期FDA...
|
|
如今的 FDA 疫苗审评,多少科学,多少政治?
2025.04.30
错过其4月1日的完全批准(full approval)截止日期后,FDA要求Novavax公司为其新冠疫苗开展另一项随机临床试验,这一决定引发了行业的广泛关注。根据《华尔街日报》(WSJ)的独家报道,该要求对Novavax带来巨大的经济和时间压力,同时也被业界解读为疫苗审批流程的新变数。
Novavax...
|

|
FDA 提醒 API 企业关注 DMF “独立”和“预先”...
2025.04.30
在4月举办的仿制药论坛(Generic Drugs Forum, GDF)第二天,话题涉及关于药物主文件(Drug Master s, DMFs)的审评机制,Lachman资深专家撰文深入探讨了GDUFA III(仿制药使用者付费法案)对DMF审评以及DMF审评流程的影响。
对于我国广大仿制药和API出口企业,GDUFA III框架...
|

|
WHO 定稿亚硝胺指南,强调来源风险
2025.04.29
2025年4月15日,世界卫生组织(WHO)随最新TRS1060报告发布了《关于预防和控制药品中亚硝胺的良好实践考量》指南,相对2024年4月的征求意见稿做了大幅修订。在风险评估、污染源分析以及可接受摄入量(Acceptable Intake, AI)等方面进行了重要调整和补充,总体方向是弱化了征求意见稿...
|

|
WHO 总部面临重组,削减大量高层
2025.04.29
世界卫生组织(WHO)总部正面临一场重大重组,旨在应对迫在眉睫的预算危机。据外媒Health Policy Watch独家报道,WHO计划将其日内瓦总部的部门和管理层大幅削减,同时将部分职能迁移至其他地区。这一重组计划不仅是对当前预算困境的响应,也是对WHO组织架构的一次深刻调整。据报道,WH...
|

|
国际药政每周概要:FDA 质量管理成熟度继续试点,EP...
2025.04.29
【早期研发与临床】
4.23,【FDA】探索使用卫生信息交换标准(HL7)快速医疗保健互操作性资源(FHIR)向 FDA 提交从真实世界数据来源创建的研究数据;建立公开档案;征求意见
【药学研究与仿制药】
本周BE指南:
【生产质量】
4.23,【EDQM】欧洲药典委员会(EPC)采纳...
|
|
欧洲药典采纳高通量测序(HTS)检测生物药病毒污染
2025.04.28
4月23日,欧洲药典委员会(European Pharmacopoeia Commission,EPC)在第181次会议上通过了一项具有里程碑意义的新通则——“高通量测序(High-throughput Sequencing,HTS)检测病毒外源因子”(2.6.41)。
该通则曾于2024年5月征求意见,此次采纳后,将于2025年10月在欧洲药典(P...
|

|
欧洲药典拟大幅更新微生物检测替代方法通则
2025.04.28
4月8日,欧洲药品质量管理局(EDQM)在其官方刊物Pharmeuropa第37.2期上发布了修订版通则5.1.6《微生物质量控制的替代方法》(Alternative methods for control of microbiological quality),公开征求公众意见。
传统的基于生长的微生物检测方法已使用超过一个世纪,存在的...
|

|
国内药政每周导读:ICH M13B 多规格 BE 豁免中文,...
2025.04.28
【注册审批】
4.21,【CDE】常见一般性技术问题解答新增3个问题,涉及生物样品检测机构
【CMC药学研究】
4.22,【NMPA】关于发布仿制药参比制剂目录第九十一批的通告
4.22,【CDE】关于公开征求 ICH《M13B:其他规格的生物等效性豁免》指导原则草案意见的通知
【生产质量】
...
|

|
【周末杂谈】美国仿制药政策的一项弊端
2025.04.27
当年推动仿制药发展的法律政策,其实也是后来限制仿制药发展的根源
美国的药物政策以创新为首。允许仿制药生存,是不得已的权宜之计,否则医保崩溃。我国的药物政策,在可见的将来,应以创新还是仿制为主,也许是值得讨论的国计民生问题。
提起这个问题,是因为过去这周的一些经历和观...
|
|
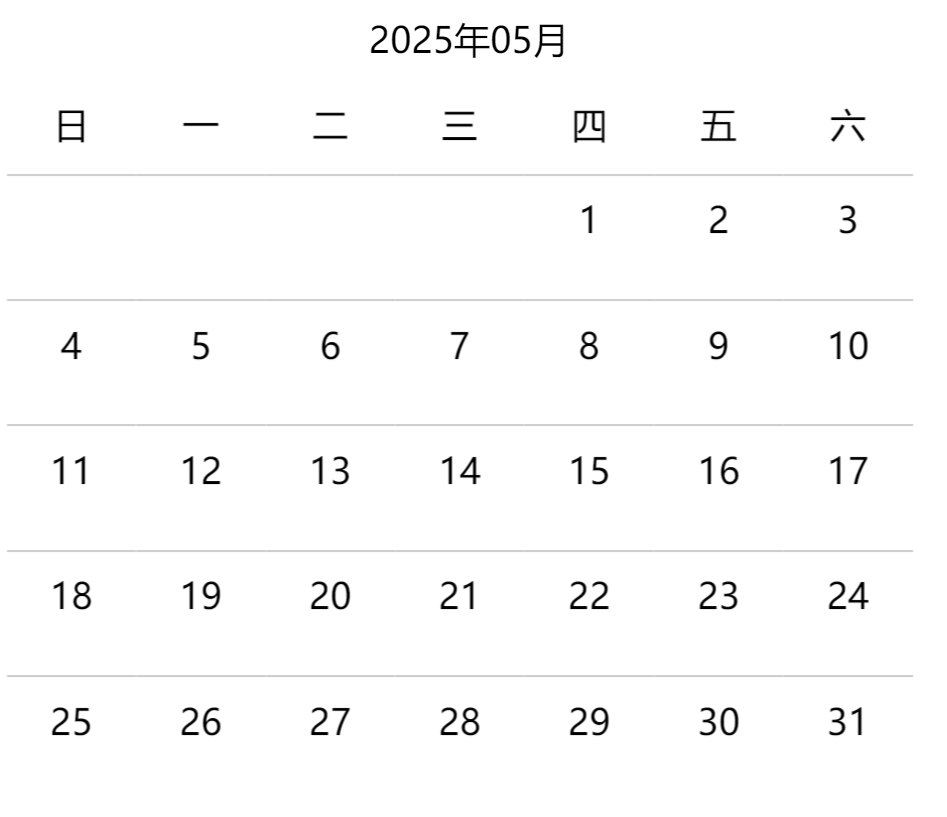
【会议日历】5月重点:IPEM人工智能课,药典委解读25...
2025.04.26
会议是医药产业学习的关键途径之一。会议数量太多,质量参差不齐,没有实时更新提醒的平台,经常会错过一个好会,或者在一个缺乏知识内容的会耽误时间,无处吐槽。
识林会议日历,专门搜集国内外有专业声誉和影响力的会议日程,梳理详细信息和原始链接,并提供评分和评价功能,可分享参...
|

|
EMA 发布思考性文件,推动生物类似药开发减负
2025.04.25
4月1日,EMA发布了《关于在生物类似药开发中采用定制的临床方法的思考性文件》(Reflection paper on a tailored clinical approach in biosimilar development)草案,这份文件标志着欧盟在推动简化生物类似药开发的进程中迈出了新的一步。
长期以来,生产商一直希望在全球...
|

|
全球监管机构合作,协调简化生物类似药上市路径
2025.04.25
4 月 21 日举办的 Medicines for Europe 年度生物类似药会议上,来自世界各地的监管机构代表齐聚一堂,围绕生物类似药的监管趋同展开深入讨论,分享经验与见解,并探讨了未来合作的可能性。
EMA:临床试验的局限性与科学进步
EMA生物类似药工作组成员 René Anour 回顾了...
|
|
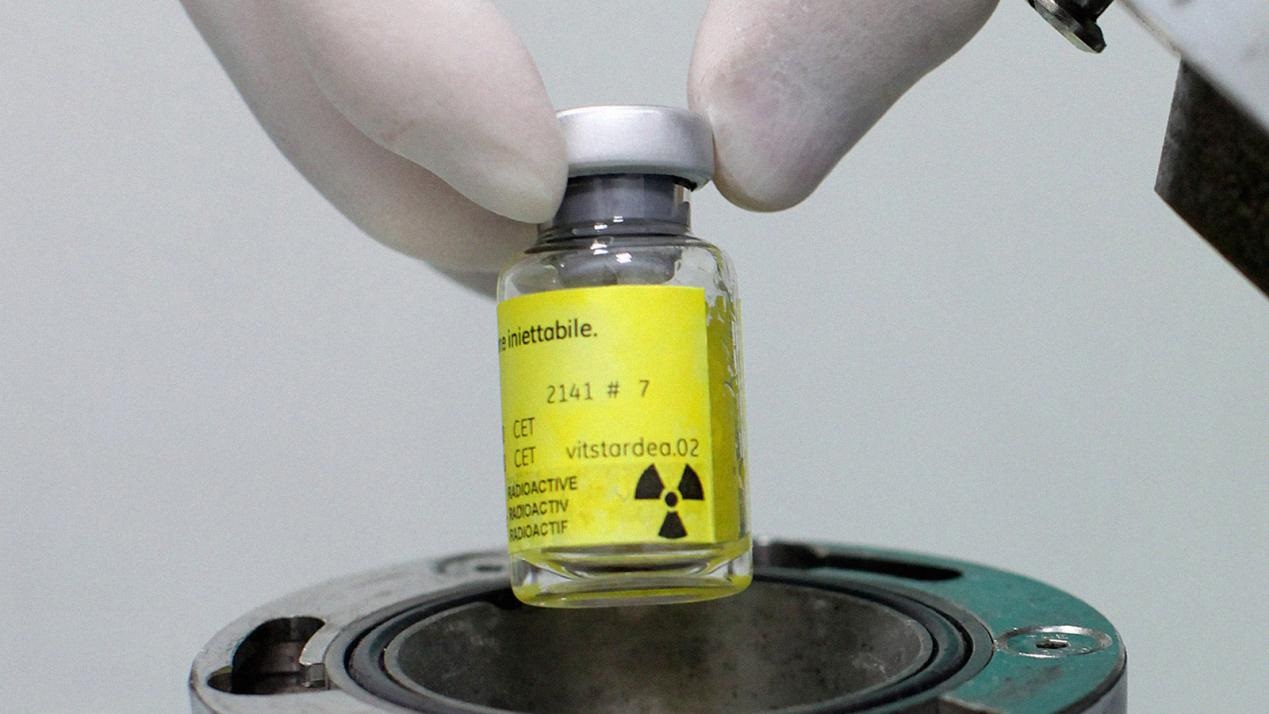
欧盟多举措应对放射性药物短缺
2025.04.24
欧洲药品管理局(EMA)与药品管理局总部(HMA)通过药品短缺与安全执行指导小组(MSSG)发布报告,提出多项措施应对放射性药物潜在的供应链短缺风险,强调通过提升本土产能、统一运输标准、强化监测协调等措施,构建一个更安全、可持续的放射性药物供应体系。
供应链脆弱性:依赖进口...
|
|
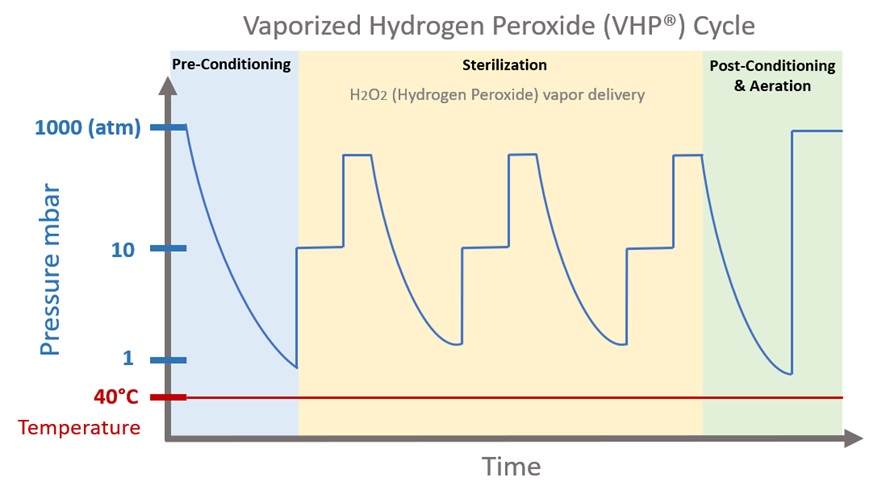
VHP(过氧化氢蒸汽)的“脆弱性”:MHRA 博客的后续...
2025.04.24
在制药行业,过氧化氢蒸汽(Vapour Hydrogen Peroxide,简称VHP)作为一种消毒和灭菌手段,一直备受关注。2018年,时任英国药品和健康产品管理局(MHRA)专家检查员的Andrew Hopkins曾发表一篇关于VHP的博客,引发了行业内关于其作为灭菌剂可靠性的广泛讨论。Hopkins已加入Lachman Consu...
|

|
Nature 子刊发文总结2024年 FDA 癌症药物批准与监...
2025.04.23
2024年,FDA在癌症治疗领域批准了多种新药和适应症,涵盖了不同癌种和治疗类别。监管重点在于加速审批,推动上市后确证性试验尽快完成,召开肿瘤药物咨询委员会(Oncologic Drugs Advisory Committee,ODAC)会议对复杂监管问题的透明讨论,以及与肿瘤学界的紧密合作以促进高效的药物...
|

|
FDA 局长将药企代表移出专家咨询委员会
2025.04.23
2025年4月17日,FDA局长Marty Makary宣布新政策,限制药企和其他受FDA监管的公司员工担任FDA专家咨询委员会(Advisory Committees,AC)的正式成员。这一举措是FDA在减少制药行业对监管决策影响方面迈出的重要一步。
FDA专家咨询委员会是由独立专家组成的小组,负责为FDA提供科学、...
|

|
【直播】25年4月全球法规月报划重点
2025.04.23
识林月报直播如期而至,本次直播聚焦4月全球主要监管机构的重点法规,并挑选影响力较大的文件做重点简介。短短40分钟,轻量而轻松,旨在帮助大家回顾上个月的监管重点,加深理解或是查缺补漏。
直播信息速递:
直播时间:5月6日(周二)20点
直播时长:40分钟
直播平台:识林视...
|