
|
特朗普政府通过关税推动跨国药企制造回流美国
2025.03.14
据外媒报道,特朗普用关税威胁大型制药公司,要求将制药场地迁回美国。他在2月18日对记者表示,新关税将设定在 25% 左右,并且“一年内会大幅增加”,但在国内设立工厂的公司将避免受到处罚。特朗普强调:“当他们回到美国并在这里建厂时,就不会有关税。”
2月21日,特朗普与品牌...
|
|
美智库再提“搭便车”,呼吁全球分担美药物研发成本
2025.03.13
全球生物医药领域的创新药物研发为疾病治疗带来了革命性突破。然而,关于美国在推动全球医药创新中所承担的角色,争议日益增多。这一问题常被称为“搭便车”(Freeloading),美国一些人士用它来指责一些国家不仅在国防安全上依赖美国,还在新药研发领域依赖美国市场。美国消费者和联邦...
|

|
PDA 发布质量文化评估标准,提供指导文件、模型和工...
2025.03.13
2月26日,美国非肠道药物协会(PDA)联合美国国家标准协会(ANSI)正式发布了PDA/ANSI标准06-2025《质量文化评估:质量文化指导文件、模型和工具》。这一新标准为制药和医疗器械行业提供了评估和理解质量文化的指导框架,旨在帮助企业建立和维护成熟的质量文化。
该标准详细阐述了...
|

|
业界挑战 FDA 加速批准新规,学界则认为力度仍不够
2025.03.12
加速批准路径自诞生以来就伴随从未停歇的争议。FDA 于 1 月 6 日发布了题为《加速批准以及确定是否正在进行确证性试验的考量因素》的指南草案,澄清了有关如何认定确证性试验正在“进行中”的标准,并说明了 FDA 计划如何落实新的加速审批政策。指南草案还指出,“在某些情况下,当 ...
|

|
USP 发布首份“脆弱”药品清单,100种药物存短缺风险
2025.03.12
2025年3月4日,美国药典(USP)发布了其首份《脆弱药品清单》(Vulnerable Medicines List, VML),列出了100种存在短缺风险的药品,旨在通过预判和干预,减少因供应链断裂导致的医疗危机。
清单的由来:从被动应对到主动预警
USP 在2023年发布的《全球公共政策立场》中提...
|

|
国际药政每周概要:FDA 持续动荡,EMA 推出欧洲临床...
2025.03.12
【早期开发与临床】
3.3,【EMA】推出欧洲临床试验互动地图
【注册审批】
3.6,【MHRA】先进疗法药品:英国的监管和许可
【生产质量】
3.4,【WHO】关于化学对照品建立、管理及销售的一般指导原则
本周 483 和警告信
【监管综合】
3.3,局长待定,FDA 忙着...
|
|
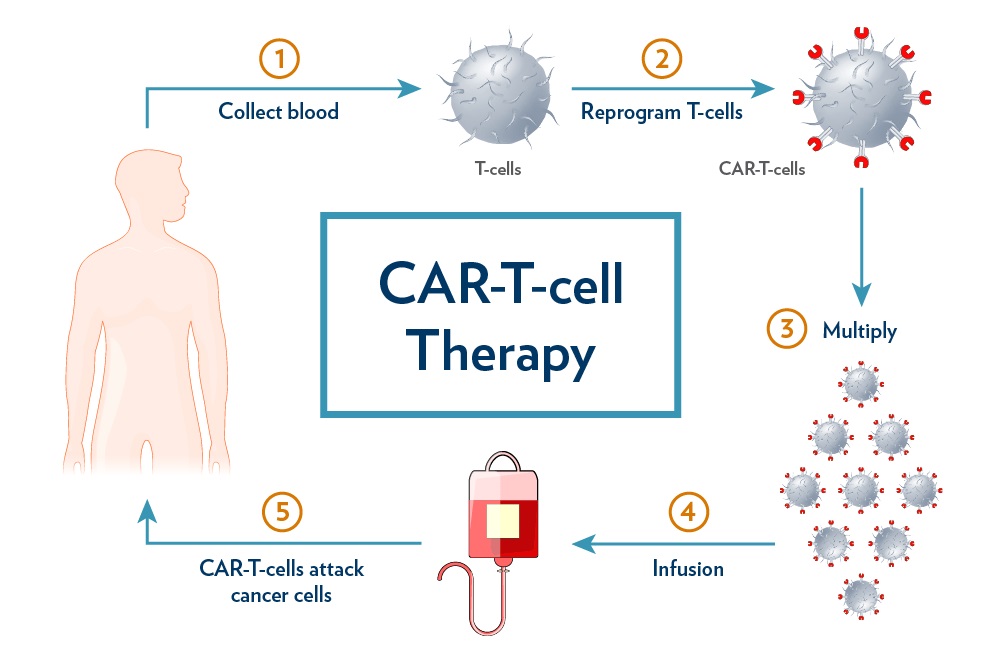
FDA 拟调整 CAR-T 疗法继发性癌症黑框警告
2025.03.11
FDA计划基于最新安全性数据修订CAR-T细胞疗法的继发性恶性肿瘤风险警告。与此同时,行业呼吁简化治疗标签要求,以扩大患者可及性,并探索CAR-T在自身免疫疾病等新适应症中的应用潜力。
FDA警告声明调整:几经波折,未来可期
生物制品评价与研究中心(CBER)主任Peter Marks近日...
|

|
日本 PMDA 推出英文版索引网页,继续助力海外新药
2025.03.11
日本药品与医疗器械综合机构(PMDA)近日推出了英文版一站式索引网页(https//www.pmda.go.jp/english/int-activities/industry/0001.html 点击查看),为海外药品和医疗器械企业提供进入日本市场的全面指导。
该网页最大特色还不是英语界面,而是其页面设计充分考虑药企...
|

|
世界罕见病日,FDA 动荡中,业界呼吁合理改革
2025.03.10
2025年2月28日是第十八个世界罕见病日,美国生物技术创新组织(Biotechnology Innovation Organization,BIO)总裁兼首席执行官John F. Crowley发文,呼吁现任总统特朗普改革FDA以促进罕见病药物开发。
当前联邦政府裁员浪潮下,Crowley的措辞颇为谨慎。
首先他赞赏特朗普首...
|

|
EMA 急性呼吸窘迫综合征(ARDS)药品临床指南征求意...
2025.03.10
2025年2月28日,欧洲药品管理局(EMA)发布了修订版《急性呼吸窘迫综合征(ARDS)治疗药物临床研究指南》征求意见稿,征求意见截至2025年5月31日。
急性呼吸窘迫综合征(ARDS)是一种严重的肺部疾病,通常由系统性炎症反应综合征(SIRS)引发,表现为急性呼吸衰竭和双肺非心源性渗出...
|
|
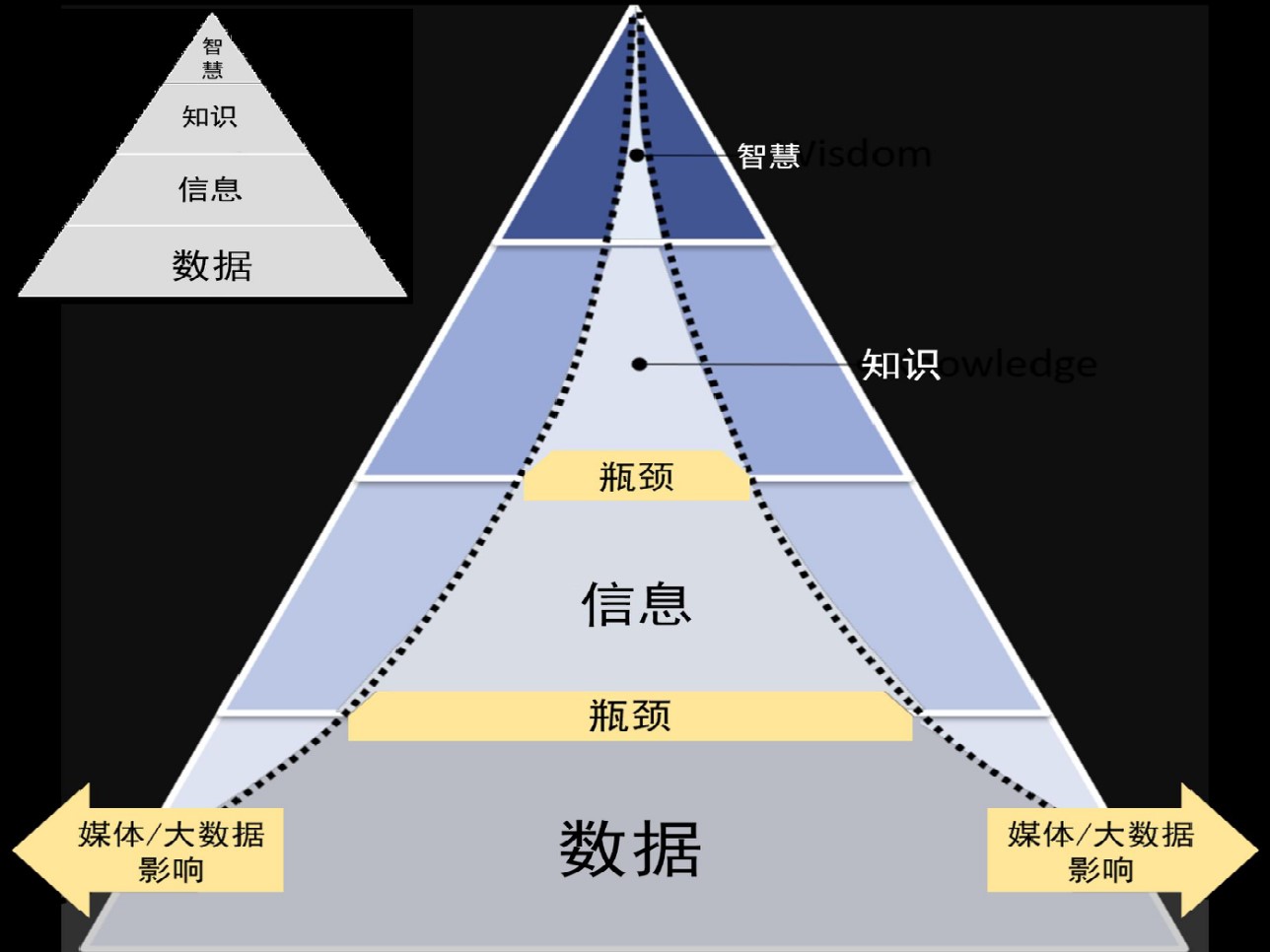
【周末杂谈】数据 → 信息→知识→智慧
2025.03.09
从数据“蒸馏”到智慧的这条路,会越走越窄?
关于真实数据(real data)与合成数据(synthetic data)的讨论,是说用来训练大模型的真实世界数据,能用的已经用的差不多了。以后,大模型的训练会越来越依靠自己产生的数据,即所谓合成数据。随着芯片速度的不断提升,大模型产生数据的...
|

|
【识林主题词】修订:GMP,细胞治疗,CAR-T、基因治...
2025.03.08
— 主题词,是识林针对制药行业的关键概念,基于大量资料的综合分析,从定义、工作流程、法规指南、文献案例等多个维度梳理的系统知识纲要。截至目前,识林【主题词库】已上线超过1000个主题词,还在陆续增补当中。
— 从主题词入手,也是使用识林的最佳方式之一。主题词的系统性、...
|

|
【识林新文章】IND 代谢研究,临床迎检,ICH 稳定性...
2025.03.08
在官方法规指南之外,识林或原创、或整理了大量对比解读、案例解析等内容,作为识林用户的参考资料,提供更多视角,与岗位实务联系更为紧密。
这类资料,全部收录在专门为此开发的“对比解读案例解析”数据库内,通过“业务标签”和“知识标签”的交叉索引,用户可迅速查阅学习本岗位...
|

|
局长待定,FDA 忙着提前退休、交周报、退租实验室
2025.03.07
尽管部分裁撤员工被召回,但FDA和HHS(卫生部)面临的裁员风暴并无停止或缓和的迹象。候任局长Makary将于当地时间3月6日接受参议院听证,而他可能接手的FDA面临的问题已经不止是裁员。
裁多少,裁谁,9月底见分晓
根据HHS于3月3日发布给员工的邮件,FDA及其他HHS员工被邀请参加“...
|
|
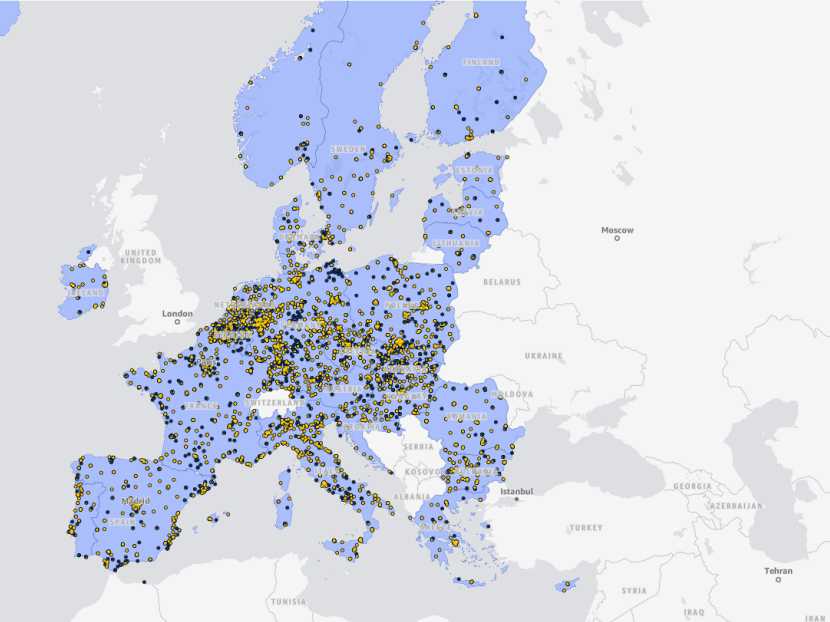
EMA 推出欧洲临床试验互动地图
2025.03.07
3月3日,欧洲药品管理局(EMA)宣布在其欧盟临床试验信息系统(CTIS)中新增互动地图功能,为患者和医疗专业人士提供更便捷、更透明的临床试验信息获取渠道。
该地图整合了CTIS中的实时信息,以直观的仪表盘形式展示正在进行的临床试验。
CTIS作为欧盟临床试验申请的唯一入口,集...
|
|
EMA 生物药品问答更新要点
2025.03.06
2025年2月25日,EMA 对生物药品问答进行了部分更新。本次更新涉及低内毒素回收(LER)研究、CTD 材料提交相关的问答。
低内毒素回收(LER)研究要点更新
关于低内毒素回收(LER)研究,更新后强调 LER 研究应当反映生产工艺的相关条件,包括温度,并应反映生产过程中的潜在保...
|

|
【直播】25年2月全球法规月报划重点
2025.03.06
本次直播聚焦2月重点法规,将挑选影响力较大的文件做重点简介。
2025年2月1日至2月28日,各机构共发布119个文件(*部分文件为多部门联合发布),包括FDA 60个,欧盟药监 44个,中国监管体系15个(含国务院 1个,NMPA 3个,CDE 7个,医保局1个,其他3个)。此外,各机构实施和废止1...
|

|
ICH Q7 How to do 文件的更新要点
2025.03.05
APIC(原料药委员会)近期发布了《How to do - ICH Q7指南解读》的最新版(第17版),基于实践经验对“如何”实施ICH Q7指南提供建议。最新版解读主要针对ICH Q7对应的章节2质量管理、5工艺设备、13变更控制中进行了补充和更新。
更新后的“How to do”文件强调了质量部门...
|

|
国际仿制药协会发布123页报告,揭示原研药企的“常青...
2025.03.05
近日,国际仿制药和生物类似药协会(IGBA,全球仿制药行业代理人,会员包括美国普享药协会AAM)发布了一份题为《系统博弈——原研药企常青策略对仿制药和生物类似药市场准入影响的综述》的报告,系统性揭示了原研药企为延长药品市场垄断期而采取的多种策略。
这些策略被统称为“常青...
|

|
国际药政每周概要:FDA 急召人员返岗,取消流感疫苗...
2025.03.05
【早期开发与临床】
2.28,【EMA】治疗急性呼吸窘迫综合征药品临床研究指南
【药学研究与仿制药】
2.26,【EMA】关于实施“ICH M13A 口服固体速释制剂的生物等效性”的考虑
2.26,【EMA】生物制品问答更新,涉及低内毒素回收
【注册审批】
2.26,【FDA】取消流感疫苗专...
|