
|
【更新提示】识林一周回顾(20190127-0202)
2019.02.03
【FDA】指南草案(重发布) 罕见病:药物研发中的常见问题(01.31) 花脸稿
该指南修订并取代2015年8月发布的罕见病:药物研发中的常见问题指南草案。识林对新旧版本的指南进行对比,具体参见花脸稿。修订包括以下内容:纳入用于评估和验证替代生物标志物的问题,描述非临床灵活性,有...
|

|
FDA发布药品“销售状态通知”指南草案
2019.02.02
美国 FDA 于 1 月 30 日发布《根据 FD&C 法案 506I 的销售状态通知;内容与格式》指南草案,帮助新药申请(NDA)和简化新药申请(ANDA)的申办人了解他们现在需要与 FDA 分享哪些关于品牌药和仿制药销售状态的信息。
该指南虽是对新药和仿制药共同的要求,在其中关于药品...
|
|
FDA 对器械监管的年终回顾与展望
2019.02.01
【编者按】随着媒体集体发难以及专家长期对 FDA 医疗器械审批体系的批评,美国 FDA 于去年 11 月宣布计划彻底改革已有数十年历史的医疗器械审批体系,之后发布了一列报告改革行动的声明,但批评者对此并不满意。借此辞旧迎新之机,FDA 局长与器械中心主任再次联合发表声明,回顾...
|

|
Advair 吸入器首款仿制产品获 FDA 批准
2019.01.31
美国 FDA 于 1 月 30 日批准了 Mylan 公司首个 Advair 仿制产品。Advair 是 GSK 公司研发的重磅哮喘治疗药械组合产品(丙酸氟替卡松和沙美特罗吸入粉剂)。Mylan 的仿制产品每日两次用于治疗 4 岁及以上患者的哮喘以及气流阻塞的维持治疗并减少慢性阻塞性肺病(COPD)患者...
|
|
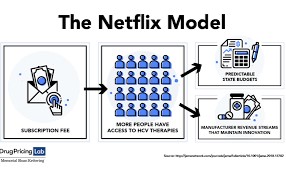
药品也能预约订购:美国地方政府采购丙肝药新模式
2019.01.30
美国路易斯安那州于今年1月10日宣布,该州将成为第一个采用Netflix模式支付昂贵的丙肝治疗方法的州,这可能会大幅增加可以治愈肝损伤疾病的人数。这种付费模式不再针对每个处方单独支付,而是类似于消费者每月支付费用来播放无限制的电视节目和电影的Netflix模式。传统上,制药商能从政府...
|

|
FDA 首次提供非处方药纳洛酮标签模板
2019.01.29
美国 FDA 通过史无前例地开发药品事实标签(Drug Facts Label,DFL)模板,表达了其对于通过非处方(OTC)途径直接提供纳洛酮来用于阿片类药物过量治疗的兴趣。潜在的非处方纳洛酮申办人可以使用 DFL 模板开展其自己的标签理解研究。
药品事实标签(Drug Facts Label,DFL)...
|

|
FDA 发布加速审批药品说明书的定稿指南
2019.01.28
美国 FDA 于 1 月 22 日发布《加速审批监管路径下批准的人用处方药和生物制品说明书》定稿指南(中文翻译),指南对于替代终点被广泛认可的治疗领域(例如,肿瘤学领域)以及那些替代终点没有被很好地了解的治疗领域分别给出了具体的说明书建议。
指南指出,对于像抗癌药等一些药...
|

|
【更新提示】识林一周回顾(20190120-0126)
2019.01.27
【FDA】REMS评估:计划与报告指南(01.25)
风险评估与减轻策略(risk evaluation and mitigation strategy, REMS)是美国食品和药物管理局的一项计划,用于监测可能产生严重不良反应的药物,是药物警戒的重要内容。该文件为处方药产品(包括生物制品)的风险评估和缓解策略(REMS...
|

|
欧洲药品管理局总部将于 3 月初搬迁至荷兰阿姆斯特...
2019.01.26
欧洲药品管理局(EMA)将在2019年3月初搬迁至荷兰。荷兰当局已经在2019年1月9日将位于阿姆斯特丹Sloterdijk镇的临时性建筑“Spark”大厦正式移交给EMA的执行董事Guido Rasi。EMA现在正在准备正式搬迁。搬迁期间,EMA必须同时确保其主要监管活动的继续进行,并相应的启动其“业务连续性...
|

|
FDA 检查的下一关注点:OOS 根本原因调查
2019.01.25
对数据可靠性(data intergrity)问题的关注还没退去,超标调查欠佳正在成为热点。美国FDA药品审评与研究办公室(CDER)国际药品质量处处长Carmelo Rosa于去年11月4-7日在费城召开的ISPE年会上表示,随着FDA对制药行业数据可靠性检查的结果开始显现,在其中发现了更多关于超标(OOS)调...
|
|
制造环节:细胞与基因疗法面临的下一个大挑战
2019.01.24
随着新型细胞与基因疗法的管线和市场的扩展,药品研发商是时候关注物流链条其它关键方面的问题了:对于复杂的细胞与基因疗法,制造环节成为行业面临的下一个大挑战。随着从较小规模的临床试验转向更大规模的临床试验,接着进行规模化生产实现商业化,受制于载体供应,病毒载体制造可能成为...
|

|
欧盟行业协会发布生物制品原辅料风险管理指南
2019.01.23
欧盟一家代表生物制药商的行业协会(European Biopharmaceutical Enterprises,EBE)于去年 12 月 17 日发布了一份题为“生物医药产品和先进治疗医药产品(ATMP)生产中使用的原辅料的管理与控制”和 ATMP 制造商为在这些产品中使用的原辅料制定风险评估计划。该文件还旨在提高供...
|

|
FDA 器械监管改革计划受到质疑
2019.01.22
图.BMJ杂志副主编Jeanne Lenzer撰写的The Danger Within US.
批评者认为,医疗器械改革计划并没有触及根本,仍然允许将未经临床试验检验的器械植入体内,对患者造成威胁。批评者提出,为公众获得安全、有效的植入器械,FDA应该将所有植入器械重新定义为高风险或III类产品,使这...
|

|
美国政府重新开张后 FDA 可能面临仿制药审评危机?
2019.01.21
我们之前曾在一篇文章中简单讨论过美国政府关闭对于 FDA 整体上的影响:【联邦政府关闭对 FDA 的影响】。今天我们看看仿制药界资深人士 Bob Pollock 先生根据其多年来对行业和 FDA 仿制药工作的了解,对于政府重新开张后 FDA 可能面临的一些麻烦的预判:
FDA 仿制药办公室(O...
|

|
【更新提示】识林一周回顾(20190113-0119)
2019.01.20
【案例】偏差调查示例和实践(01.18)
本案例来源于IPEM课程 - 偏差调查的科学认知与技术工具,列举了三个偏差调查的示例,详细讲述了偏差调查的全过程,并给出了完整的CAPA,希望能引起读者的思考和共鸣。另外还有六个偏差描述和偏差调查的示例供读者讨论和点评。检索识林警告信数据...
|

|
FDA 发布关于暂时批准 ANDA 的重要指南
2019.01.19
美国 FDA 于 1 月 16 日发布了一份题为《ANDA 递交 – 暂时批准 ANDA 的最终批准增补和请求》。这是 FDA 首次在联邦公报公布之前发布指南,FDA 在介绍指南发布的消息中附有一条说明:
“我们在 FDA 网站上发布该文件,因为该文件目前无法在联邦公报(FR)通告上公布。...
|

|
FDA 启动新计划加强与药品生产场地的沟通
2019.01.18
美国 FDA 药品质量办公室(OPQ)监督办公室启动了一个新试点计划 — 场地交流计划(Site Engagement Program, SEP),与可能会导致质量相关的药品短缺的药品生产场地加强交流以鼓励场地中的质量实践,旨在确保优质药品的供应。
OPQ 药品质量政策办公室的 Tara Gooen Bizjak ...
|

|
识林年度回顾:2018 具体产品 BE 指南
2019.01.17
FDA 在2018年度发布的 BE 指南
2018年度,FDA发布了7次产品BE指南的新增和修订,总共新发布128个产品BE指南,并对117个产品的BE指南进行了修订。
1. 阿片类药品的 BE 修订,增加“防止滥用”试验
FDA指南“评估口服固体阿片类药物仿制药的防滥用措施的一般原则”(General Principle...
|

|
从 FDA 的请愿回复看利那洛肽 BE 指南草案
2019.01.16
美国 FDA 赶在 2018 年结束前的最后几天单独发布了一篇利那洛肽(Linaclotide)生物等效性(BE)指南草案并回复了品牌商于 2016 年提交的关于该产品的请愿书。识林已发布这份 BE 指南的中文翻译。现在我们通过 FDA 对于请愿书的回复来看一看这份 BE 指南草案。
利那洛肽胶...
|

|
识林药物警戒指导工具介绍
2019.01.15
药物警戒(Pharmacovigilance,PV)作为一门新兴的学科,国际上不同监管机构对于药物警戒的法规指南更是错综复杂,它们之间有交叉重叠部分,更有大相径庭之处。这些法规指南的迭代更新,其速度之快,波及范围之广,更是让企业眼花缭乱,甚至不知该何去何从。 2017年,当时的国家食品药品...
|