
|
WHO试点生物药识别码方案,生物类似药行业表示反对
2016.11.01
世界卫生组织(WHO)似乎准备继续坚决向前推进对所有生物药实施“生物药识别码(Biological Qualifier,BQ)”的方案,尽管来自欧洲仿制药和生物类似药企业呼吁暂停该项目,等待该提议对药品可获取性的影响评估。
在今年4月举行的第62次国际非专利名(INN)磋商会上,WHO INN专家组表...
|

|
开发下一个女性伟哥?FDA发布指南草案
2016.10.31
RAPS文章url:备受争议地,美国FDA在去年批准了第一例用于治疗女性困扰的性欲低下的药物,这为其他公司打开了一扇门开发类似药物。
现在,FDA试图为开发下一个女性伟哥的竞争者阐明应该关注的内容,对涉及的挑战进行了特别讨论,包括诊断标准、临床终点和患者报告结果(Patient-repo...
|

|
FDA强调在推进生物技术监管中的控制策略沟通重点
2016.10.30
美国FDA药品审评和研究中心(CDER)生物技术产品办公室(OBP)审评领导人Sarah Kennett在今年五月份召开的2016 CASSS CMC欧洲战略论坛上强调,生物技术产品和工艺知识为监管变革创立了基础,但制造商和监管机构之间密切的沟通和协调对于实现这些确保和推进产品质量的变革将是非常必要的。...
|

|
FDA新检查方案项目背景与进展概览
2016.10.28
背景
美国FDA药品审评与研究中心(CDER)药品质量办公室(OPQ)于2015年初成立,其口号是“统一的质量声音”。Michael Kopcha博士是OPQ的主任,办公室大约有1000名员工,OPQ的目标是:
a) 简化监管流程,整合主要功能领域,以推动品牌药和仿制药产品从批准前到批准后的质量的生命...
|

|
原料药供应来源的变化能否通过可比性协议向FDA提交
2016.10.26
多年来我一直在努力说服企业,对于已获批ANDA的某些变更必须始终作为之前已获批申请的补充申请(PAS)提交,或者在某些情况下,这些变更可以作为在ANDA中已获批的可比性协议处理。在美国仿制药协会(GPhA)2016秋季技术会议上,FDA药品审评与研究中心(CDER)药品质量办公室(OPQ)检验和...
|

|
【更新提示】药政信息摘要2016.10
2016.10.25
主题词更新推送 REMS、预认证、生物等效性、孤儿药(罕见病)
成人用药数据外推在儿科人群药物临床试验及相关信息使用的技术指导原则 (征求意见稿)(10.29)
拟纳入优先审评程序药品注册申请的公示(10.28)
FDA征求意见稿:女性性兴趣、欲望、唤起障碍治疗性药物的...
|

|
FDA仿制药办公室GDUFA 进展更新 – 2016
2016.10.25
10月24-26日,美国仿制药协会(GPhA)2016秋季技术会议在马里兰州举行。按照历年惯例,FDA仿制药办公室(OGD)主任Kathleen (Cook) Uhl博士提供了OGD在GDUFA下的最新更新,让我们来看看有哪些亮点。
批准和积压处理
毫无疑问OGD实际收到的工作量比其在GDUFA I 期谈判期间所预期的更...
|

|
当企业在FDA的合规状态阻碍批准时应怎么办?
2016.10.24
美国仿制药使用者付费(GDUFA)计划促进了对仿制药申请人以及在申请中确定的设施检查次数的增加。随着检查次数的增加,需要由FDA检查员撰写、由其主管批准然后由药品审评和研究中心(CDER)合规办公室审查和批准的设施检查报告(EIR)随之增加。如我们在昨天的资讯【进入美国市场的制药企...
|

|
进入美国市场的制药企业最抓狂的问题是什么?
2016.10.23
什么问题最能使在美国市场的制药企业抓狂?Lachman咨询公司的Bob Pollock先生就这一问题询问了其客户,下面是他统计出的最常出现的三个问题:1)在检查或重新检查后的合规状态解决问题;2)从FDA获得直接答复;3)关于非活性成分数据库(IID)的最大日暴露量问题如何处理。
合规状态解...
|

|
ICH M9将协调基于BCS的BE豁免
2016.10.21
2016年10月,ICH公布了M9基于生物药剂学分类系统的生物等效性试验豁免(Biopharmaceutics Classification System-based Biowaivers)的概念文件和业务计划。仿制药能否申请生物等效性试验豁免,是非常重要的内容。M9刚刚进入第一步(Step 1),值得期待。下文是M9概念文件内容的中文...
|

|
ICH M10将协调生物样本分析的方法验证
2016.10.21
2016年10月,ICH公布了M10生物样本分析的方法验证(Bioanalytical Method Validation)的概念文件和业务计划,旨在推进非临床、临床生物样本分析数据在监管机构间的认可,这将影响全球药物开发和GLP、GCP现场检查。下文是M10概念文件内容的中文翻译。
拟定的协调行动类型
该拟定的...
|
|
辉瑞宣布将于11月下旬发售英利昔单抗生物类似药
2016.10.20
辉瑞公司于10月17日宣布,将于11月下旬发售其关于Janssen公司肿瘤坏死因子(TNF)抑制剂Remicade(英利昔单抗)的生物类似药Inflectra(infliximab-dyyb),距离该产品于4月5日获得FDA批准已经将近8个月的时间。Celltrion公司和辉瑞公司在联邦地区法院敲除了Janssen公司Remicade的专利之...
|
|
FDA对罕见病药物的监管灵活性和经验教训
2016.10.20
2016年10月17-18日,罕见病和孤儿药突破峰会(NORD Rare Diseases and Orphan Products Breakthrough Summit)在美国弗吉尼亚州阿灵顿市举行。FDA药品审评与研究中心(CDER)新药办公室(Office of New Drugs)主任John K. Jenkins医师的幻灯片pdf介绍了FDA的监管灵活性和一...
|

|
意大利对为涨价而紧缩抗癌药供应的制药商处以罚款
2016.10.19
意大利反垄断机构于10月14日对总部设在南非的一家大型制药商Aspen Pharmacare处以近550万美元的罚款,因其以停止供应几种抗癌药作为谈判策略旨在将价格上涨高达1500%。
这一事件开始于Aspen从葛兰素史克购买药品并与意大利药品管理局就抗癌药(包括Leukeran和Alkeran)定价开展谈判。...
|

|
FDA发布针对两个专注达仿制药的撤市听证会通知
2016.10.18
10月17日,FDA通过两份联邦公报(FR)通告分别宣布两家公司的盐酸哌甲酯缓释片撤市听证会通知(NOOH, Notice of Opportunity for Hearing)【FR通告一
所有这些都发生在近两年前,现在FDA正在启动最后的行政措施以永久性的从市场上撤回这两个产品。
识林相关资讯
2015-08-19...
|

|
GDUFA II期收费结构概览
2016.10.17
仿制药企业应做好准备支付更多费用以在美国仿制药使用者付费法案(GDUFA)重新授权时支持FDA仿制药计划。GDUFA II期将于2017年10月1日开始实施,年度收费目标为4.936亿美元,比GDUFA I期最后一年的目标费用3.23亿美元高出近53%。
根据10月14日FDA发布的承诺函草案,GDUFA II期的...
|
|
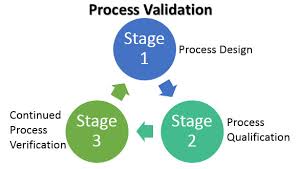
FDA表示早期工艺验证研究可避免批准前检查缺陷
2016.10.16
FDA官员强调在早期明确对制造工艺的设计以支持后期工艺验证研究的重要性。检查员发现在批准前检查(PAI)中的许多缺陷来自于不充分的第一阶段工艺验证工作。最好的工艺验证计划是那些使用探讨多个变量如何影响制造工艺的稳健的风险管理模型。FDA表示早期工艺验证研究必须足够稳健以支持商...
|

|
无国界医生组织就辉瑞拒绝降低疫苗价格表示谴责
2016.10.14
无国界医生组织(Doctors Without Borders)在对辉瑞的尖锐批评中拒绝了辉瑞捐赠一百万剂肺炎疫苗的提议,因为这样的行为可能会“削弱”增加贫穷国家人民获得疫苗的“长期努力”。相反,该组织再次推动辉瑞降低疫苗价格。
该组织曾与辉瑞就其肺炎球菌13价组合疫苗开展了长达7年的讨价...
|

|
2016财年FDA ANDA批准和接收数据已公布
2016.10.13
FDA仿制药办公室(OGD)于10月11日发布了2016全财年的批准和接收数据以及一些其它指标。9月份OGD批准的51件ANDA,2016财年总批准量为651件,平均每月54.25件。这至少是过去8年(也许更长时间)在一财年中批准量最高的年份,并且是GDUFA I期批准量最多的一年(之前最高的是2015财年的492件...
|

|
FDA或于明年推广新检查方案项目
2016.10.12
FDA的新检查方案项目(New Inspection Protocols Pilot Project, NIPP)正在以比一年前FDA官员所期望的更慢的速度进展,这意味着FDA最早在明年之前都不会定期使用方案。NIPP的承诺:从一个场地到另一场地以及从一个检查员到另一检查员的检查更具可比性,对超越基础合规的设施予以认可。...
|