
|
持感恩之心,多看看药业的积极面
2016.11.25
凡事总有其积极面和消极面,且随视角不同而异。日常生活工作中,人们常对消极面关注和议论较多,所谓不知足方可进步。今天,借感恩节之际,让我们来多看看积极面的事、值得感恩的事。
(1)患者有理由感恩
国内药品质量安全问题曝光不断,似乎民众用药安全总处于危险边缘。其实不然。从...
|

|
同一临床试验再次导致两名癌症患者死亡
2016.11.24
继三名癌症患者于今年月在Juno Therapeutics公司免疫治疗药物嵌合抗原受体T细胞疗法(CAR-T)JCAR015实验性治疗中死亡后,11月23日,同一临床试验又致两名患者死亡。
今年7月,在三名患者因脑水肿死亡后, FDA已经暂停其临床研究,禁止招募新的患者入组。但Juno公司坚持认为问题不在...
|

|
【专栏】美国FDA的决策逻辑 - 上
2016.11.23
美国大选,特朗普胜出,世界更加热闹起来。这位候任总统在竞选中说了很多让人惊诧的话,各种猜测和担心泛滥。美国对世界的影响力可见一斑。生物医药和医疗器械行业倒是乐观,忽略了特朗普对药品价格的关注,憧憬于其有关放松监管的承诺,以及“改革FDA”(reform FDA)的考虑。《福布斯》...
|

|
GDUFA II期年度项目费需要企业更好地准备!
2016.11.22
在GDUFA II期谈判中,收费结构发生了一些重大变化。例如,直到已获批ANDA指定某个场地之前该场地不缴纳年度场地费;CMO将只需支付1/3的场地费;取消已获批申请的补充申请(PAS)费;如果一家企业既生产API也生产成品制剂,仅需支付一种场地费而不是两种;另外,最重要的改变是引入三层年...
|
|
在药品可及性方面干得好的制药商有哪些?
2016.11.20
制药企业经常因没有做到保证药品对中低收入国家人群的可及性而受到谴责。然而,真实情况实际上更为微妙,根据药品可及性基金会(一家位于荷兰的非营利性机构)一份新发布的报告,发现一些(但不是所有)制药商正在这方面取得进展。例如,一些企业正在合作开发所需药品。另外一些企业正在承...
|

|
FDA 2017财年首月ANDA批准和接收数据
2016.11.18
2017财年第一个月的仿制药数据与2016财年的大多数月份相同。FDA仿制药办公室(OGD)完全批准54件ANDA,暂时批准16件ANDA,作为GDUFA第五年的开端共计70件批准行动。完全回应函保持在151封,再次与去年的平均量一致。
Activities Report of the Generic Drug Program
令人震惊...
|

|
2016财年FDA首仿批准量
2016.11.17
今年五月,我们曾对GDUFA实施以来过去三年和本财年第一季度的首仿批准量做了更新。【2014财年和2015财年FDA首仿批准量 - 识林资讯 2016/5/19】11月15日,FDA仿制药办公室公布了2016财年全年的首仿药批准清单,现在我们可以整体来看看GDUFA实施后四年来的首仿药批准情况。
财年
首...
|

|
EMA 首次人体临床试验指南修订
2016.11.16
2016年11月15日,EMA发布了《首次人体临床试验指南修订征求意见稿》,征求意见截止至2017年2月底。
欧洲药品管理局(EMA)与欧盟(EU)成员国合作,提议修改现有的《首次人体临床试验指南》,以进一步提高试验受试者的安全性。指南修订开放供公众咨询至2017年2月28日。修改意见通过提供...
|

|
FDA预计2016年新分子实体批准量下降
2016.11.15
FDA的批准指标不可能永远保持在创纪录的水平,目前看来趋向平均的回落已经开始。美国FDA药品审评与研究中心(CDER)新药办公室(OND)主任John Jenkins表示,2016年新药批准比去年有所下降,部分原因是由于FDA收到的NDA较少。Jenkins还表示,标准新分子实体(NME)申请的首轮批准率有所下...
|

|
美卫生部监察部门加强对药品定价的关注
2016.11.14
美国卫生与人类服务部(HHS)的监察部门正在扩展其准备审查的药品问题清单,以解决日益增长的对处方药的关注。
无论是应国会要求还是后续跟进问题,HHS监察长办公室(OIG, Office of Inspector General)会定期编写有关这些事项的报告。但根据近日发布的2017财年OIG工作计划,OIG...
|

|
【专栏】白宫即将易主,FDA又会怎样?
2016.11.13
【编者按】FDA作为美国政府在医药业产业政策方面的主要调节工具之一,随着政府换届、政策更迭,其工作内容的轻重缓急自然会有所调整。另一方面,作为药业科学监管机构,其对药品安全、有效、质量可控、及对风险和获益权衡的考量也会遵循内在自然和社会科学规律。这两方面因素在今后若干...
|

|
辉瑞降低提供给人道主义团体的疫苗价格
2016.11.12
为缓和激烈的指责,辉瑞已经向为贫困国家供应疫苗的非政府组织降低了其肺炎球菌13价疫苗的价格。辉瑞将以每剂3.10美元的价格销售其最新版本的Prevnar 13疫苗(辉瑞官网新闻稿),这意味着对每名儿童进行三剂疫苗接种的费用为9.30美元。这与Gavi自去年以来支付的价格相同。Gavi是一个国...
|

|
FDA发布公民请愿最终规定,拒绝了业界要求的修改
2016.11.11
11月8日美国FDA发布在联邦公报的关于公民请愿的最终规定的规定。最终规定仅对其拟议规定进行了微小修改,最明显的是将FDA回应时限从180天缩短到150天。
FDA经常收到请愿要求FDA不要批准某一特定的ANDA或505(b)(2)申请,除非符合某些标准,例如证明生物等效性的特定方法。国会被迫通过F...
|

|
ISPE-PQRI工艺验证和统计学研讨会简报
2016.11.09
2016年10月24日至27日,国际制药工程协会(ISPE,International Society of Pharmaceutical Engineering)和药品质量研究所(PQRI,Product Quality Research Institute)在美国华盛顿地区Bethesda联合举办了为期4天的“工艺验证和统计学”研讨会。自2011年FDA发布新的《工艺验证》(PV...
|

|
【历史】协同合作将青霉素提供给二战中的部队
2016.11.08
(译自FDA Voice “The Race to bring Penicillin to the Troops in WWII” 2016年11月7日,作者:John P. Swann, Ph.D.,FDA历史学家。)
在美国退伍军人日,我们回忆起将近75年前,几十所美国学术、商业、非营利和政府机构(包括FDA)加入了一场为在第二次世界大...
|

|
日本医药开支急剧上升引发政府高层关注
2016.11.06
日本医疗开支的急剧上升(这部分是由昂贵的新药导致的)目前引起了日本最高政治层面的关注,日本首相安倍晋三要求高级国家经济委员会认真研究削减医疗领域预算支出的方法,同时增加对迅速上涨的医药花费的官方关注。
在10月14日举行的经济和财政政策委员会(CEEP)第十六次会议上,安倍...
|

|
从Exondys 51批准看FDA内部最高层审批争议及决议的形...
2016.11.05
【相关阅读】:FDA最新药品审批展示的各方言行 - 识林资讯 2016/9/20
从最新公布的一批文件中看,即使在最后一步,美国FDA对Sarepta公司杜氏肌营养不良症(DMD)药物Exondys 51(eteplirsen)的审评仍充满合作和争议。FDA局长Robert Califf发布的支持Exondys 51的加速批准的决...
|

|
FDA正构建关注CMC审评和检查的新指示板工具
2016.11.04
美国FDA正在构建一个指示板(dashboard)工具以从FDA的化学、生产和控制(CMC)审评文件库中解放一些关键信息,使得审评更加一致并且更加强调造成最大风险的生产问题。该指示板将帮助FDA通过治疗领域比较药品,尤其是相同参照药品(RLD)的仿制药,努力做到更恰当的管理产品相关的质量风险...
|

|
ECTD在FDA的强制实施大限将至
2016.11.03
翻译自2016年9月22日的“FDA/CDER SBIA CHRONICLES”,“FDA要求在将来监管递交中使用eCTD格式和标准化研究数据 (FDA Requires Use of eCTD Format and Standardized Study Data in Future Regulatory Submissions) ”
FDA现在要求一些递交采用eCTD格式。另外,递...
|
|
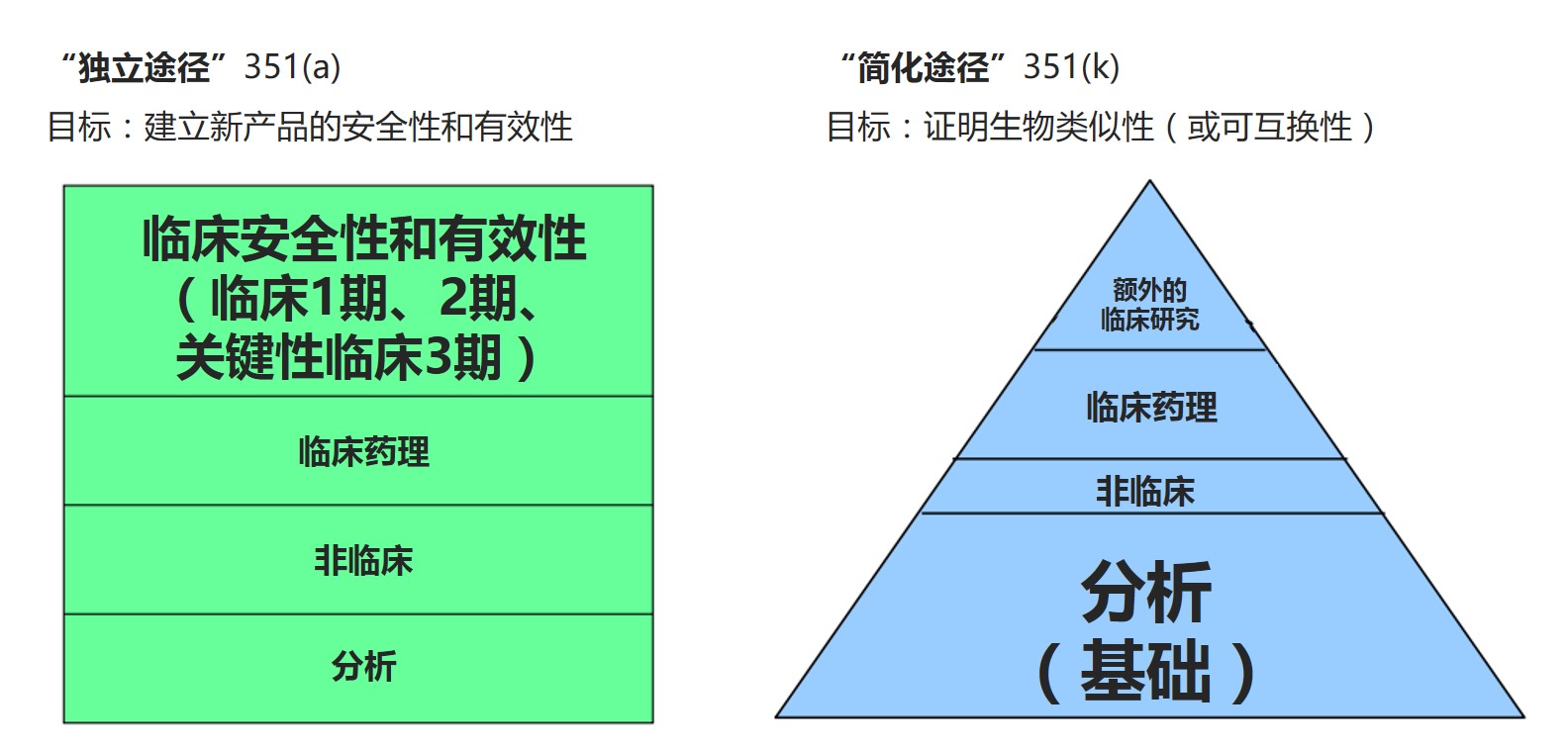
FDA分享关于生物类似药开发的经验教训
2016.11.02
随着工业界对生物类似药的兴趣持续增长,美国FDA的高级官员敦促申办人很好的利用FDA的建议并遵循最佳实践,以确保其生物类似药开发项目的及时成功。根据FDA新药办公室治疗生物制品副主任Leah Christl表示,目前在美国有针对20个参照产品的66个生物类似产品在研,其中有来自7个不同申办人的...
|