
|
【人物】强悍如铁:FDA CDER主任Woodcock
2016.09.21
她曾被垂死孩子的家长袭击、被消费者群体诋毁、接受国会“拷问”,但在过去30年中,FDA药品审评与研究中心主任Janet Woodcock医师已经崛起成为美国食品药品管理局的最高药品官员并继续留在这一位置上。
美国国家卫生委员会(患者倡导、制药公司以及其他各方的联盟)首席执行官Marc Bout...
|
|
FDA最新药品审批展示的各方言行
2016.09.20
【编者按】药品批准是基于科学的,药监局是基于科学和知识的监管机构。那么是否药品的批准就应以科学为唯一标准,药监局就应只关注科学而不顾其它?药品首先是一种商品,作为商品应首先考虑到是消费者需求,尤其是面对的消费者是数量极少的生命垂危或者生活质量受到极大威胁而无药可治的罕...
|

|
生物类似药可互换性的重要性大不如前?
2016.09.19
对于药品花费的日益担心和争论似乎已经使得FDA可互换性认定对于生物类似药在市场上站稳脚跟变得没有那么受欢迎或者没有那么必要。对于支付方来说,生物类似药定价可能比产品是否是可互换的意味着更多。
9月7-8日举行的美国仿制药生产商协会(GPhA)生物类似药委员会会议上,Momenta制...
|

|
美国收紧对临床试验透明度的规定
2016.09.18
美国收紧对临床试验透明度的规定
— 临床试验不论成功与否,都要求研究者完全披露
根据美国卫生与人类服务部(HHS)和国立卫生研究院(NIH)于9月16日发布的规定,令人失望的临床试验结果将不再能够遮遮掩掩、羞于示人。
各界期待已久的HHS对临床试验披露法律的这一修改,首次...
|

|
FDA 2016财年8月ANDA批准数据
2016.09.17
FDA仿制药办公室(OGD)8月完全批准51件ANDA,暂时批准14件,总共65件批准行动。本月共接受59件新原始ANDA,低于本财年的月平均接收量72件(但请注意是由于本财年有两个月接收量拉高了平均值,12月180件和3月114件)。
Activities Report of the Generic Drug Program (FY 201...
|
|
美国会提出两党议案要求制药商论证并限制价格上涨
2016.09.16
为回应对医药费用愤怒的升级,一个由两党国会议员组成的小组于9月15日提出一项议案,要求制药商对某些涨价10%以上的产品在涨价之前论证其价格并提供成本明细账单。
根据由亚利桑那州共和党参议员John McCain和伊利诺伊州民主党众议员Jan Schakowsky共同倡议的《公平药价法案》,将要...
|

|
中国和印度近期没有计划加入ICH和PICS
2016.09.15
根据美国行业媒体Regulatory Focus(RF)报道,两个最大的国际药品监管组织 — 国际医药品稽查协约组织(PIC/S)和人用药品注册技术要求国际协调理事会(ICH)表示中国和印度在近期没有任何计划加入任何一个组织。
PIC/S主席Paul Hargreaves在9月12日在美国华盛顿特区举行的PDA/F...
|

|
民众为何对制药业的好感每况愈下?
2016.09.14
据盖洛普(Gallup)民意调查机构的跟踪研究,美国民众对药业的好感每况愈下,在今年8月3-7日的民意调查中甚至是创下了历史最差水平,仅比排名垫底的“联邦政府”略高一筹。
相比之下,餐饮业最受民众喜爱,给予正面评价的比例达到66%,负面评价仅7%,净正面评价高达59%。自从2001年...
|

|
罕见儿科疾病优先审评券计划即将过期
2016.09.13
罕见儿科疾病优先审评券(PRV)(下简称为“儿科PRV”)计划允许审评券持有人对任何其所选择的申请拥有可转移的优先审评,如果没有国会行动的话,儿科PRV计划将于10月1日过期。罕见疾病倡导者们正推动患者和其他相关人员给自己的国会议员写信以确保计划的更新不会滞后。《21世纪医药法案》...
|

|
美国生似药商业上市通知条款争议可能重回法庭
2016.09.12
Apotex公司紧跟Sandoz公司之后敦促美国最高法院审查上诉法院对推迟生物类似药到获得FDA许可6个月以后上市的裁定。Apotex公司希望最高法院表示企业不需要等到FDA许可其培非格司亭和非格司亭生物类似药后才能向Amgen提供180天商业上市通知。
9月9日Apotex公司向最高法院提交上诉书
这...
|

|
ANDA适用性请愿继续止步不前
2016.09.10
9月6日发布在regulations.gov上的一封与ANDA适用性请愿有关的信函引人注意。请愿者(Kamat制药公司)在该信中表示其于2014年6月13日提交关于盐酸曲唑酮口服液的ANDA适用性请愿,并且已经于2015年12月30日回复了FDA于2015年10月27日发出的信息请求,但到现在为止距离原始请愿提出已经两年...
|

|
FDA提醒企业控制来自设备和包装系统的金属杂质
2016.09.08
美国FDA最近于8月22 – 23日召开的有关国际协调理事会(ICH)Q3D元素杂质指导原则实施问题的公开会议上,一位FDA演讲人建议,制药商应注意制造设备和包装容器以确保不会超过ICH Q3D指导原则中规定的金属杂质阈值,并查阅与这些主题相关的美国药典(USP)指导。同时,一位工业界人员在会...
|

|
FDA药品登记和场地注册最终规定内容摘选
2016.09.07
8月31日美国FDA发布对药品场地注册和药品登记法规修订的https//www.federalregister.gov/articles/2016/08/31/2016-20471/requirements-for-foreign-and-domestic-establishment-registration-and-listing-for-human-drugs?utm_campaign=pi+subscription+mailing+list&utm_medi...
|
|
EpiPen价格飞涨III:反垄断违规调查请求铺天盖地
2016.09.06
【编者按】在美国社会、媒体和国会对Mylan公司的肾上腺素自助注射剂EpiPen价格飙升的讨论热烈展开时,STAT于8月25日发布的一篇https//www.statnews.com/2016/08/25/mylan-antitrust-epipen-schools 独家报道提起了人们对于Mylan公司涉嫌反垄断违规关注,继而参众两院议员陆...
|

|
GDUFA II期谈判完成,关键条款一瞥
2016.09.05
在FDA和工业界解决了关于收费方案的遗留问题后,仿制药使用者付费计划重新授权谈判已经完成。除了ANDA审评过程的进一步简化和沟通增强,一些申办人应该还可以看到费用减免,这是在谈判开始工业界要求的主要问题之一。
根据8月31日发布的会议纪要显示,最终协议于8月24日的一个15分钟的...
|

|
FDA宣布对阿片类和苯二氮卓类产品添加黑框警告
2016.09.04
8月31日FDA发布了一份安全警示公告,由于对潜在致命相互作用和严重不良反应的持续担心,在所有阿片类和苯二氮卓类产品上添加黑框警告。警告指出,“FDA审查发现,越来越多的阿片类药品和苯二氮卓类产品或其它抑制中枢神经系统(CNS)药品的组合使用导致严重副作用,包括呼吸减缓或困难和死...
|

|
FDA与工业界定于11月正式讨论标签外使用交流问题
2016.09.03
美国FDA于8月31日宣布将于11月9日-10日安排为期两天的公开听证会,全面审查关于企业已获批药品和医疗器械的未批准使用的标签外交流的法规和政策。https//www.federalregister.gov/articles/2016/09/01/2016-21062/manufacturer-communications-regarding-unapproved-uses-of-approve...
|
|
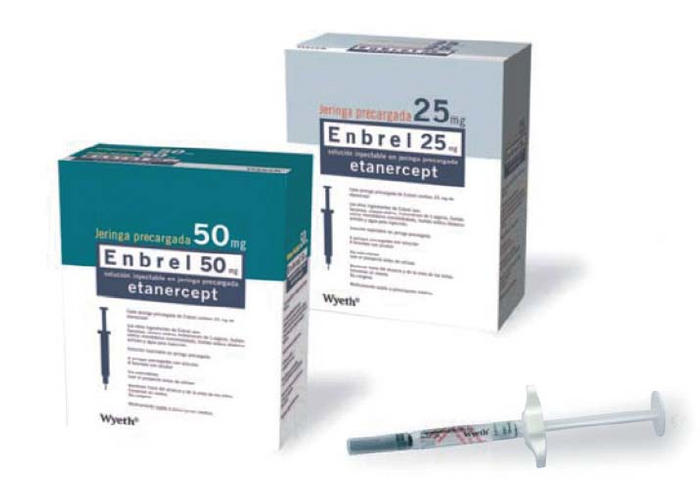
依那西普生物类似药获FDA批准
2016.09.02
美国FDA于8月30日批准了Sandoz公司对Amgen的Enbrel(依那西普)的生物类似药 — Erelzi(etanercept-szzs)。这一批准毫无悬念,Erelzi于7月13日在FDA关节炎咨询委员会专家会审中获得一致投票支持。【识林资讯 - 依那西普生物类似药获专家会审一致通过】
Erelzi的获批适应症包括参照产...
|

|
FDA发布最终规定修订场地注册和药品登记相关法规
2016.09.01
8月31日美国FDA在联邦公报(FR)通告中发布对药品场地注册和药品登记的法规修订,修订后的https//www.federalregister.gov/articles/2016/08/31/2016-20471/requirements-for-foreign-and-domestic-establishment-registration-and-listing-for-human-drugs?utm_campaign=pi+subs...
|

|
7月仿制药计划行动报告更新
2016.08.31
虽然在更新数据方面没有太多新的数据或趋势,但很显然美国FDA仿制药办公室(OGD)正在发布更多完全回应函(CRL)。OGD 7月份发布169封CRL,成为2016财年次高的月份(4月份最高190封)。这些数字也比过去几年显著更高。
Activities Report of the Generic Drug Program (FY 201...
|