
|
2500 万美元:Dr. Reddys 召回雷尼替丁的代价
2019.11.19
在发现雷尼替丁中潜在致癌物亚硝胺含量超出可接受水平后,最近许多仿制药商从美国市场召回了他们的雷尼替丁产品。根据仿制药商之一 Dr. Reddy's 的财务报告显示,召回的财务打击并不小。
虽然其他制药商没有报告召回成本,但印度 Dr. Reddy's 很好地说明了必须花多少钱来弥补其...
|

|
FDA 批准首款可减缓儿童近视进展的隐形眼镜
2019.11.18
美国 FDA 于 11 月 15 日批准了首款可在开始治疗时减缓 8 至 12 岁儿童近视进展的隐形眼镜。这款隐形眼镜名为 MiSight,为一次性使用,用后即抛的软性隐形眼镜,在每天晚上睡前丢弃,不建议配戴过夜。
FDA 器械与放射健康中心(CDRH)眼科、麻醉、呼吸、耳鼻喉科和牙科办公室主任 ...
|

|
【更新提示】识林一周回顾(20191110-1116)
2019.11.17
【CFDI】公开征求《疫苗生产现场检查指南》(征求意见稿)的意见(11.13)
为指导检查员对疫苗生产企业的生产现场检查,制定本指南,作为疫苗生产现场检查基础性技术指导文件。检查员可参照本指南的要求,对企业的生产和质量管理进行检查。检查过程中,检查员应依据《药品生产质量管理...
|
|
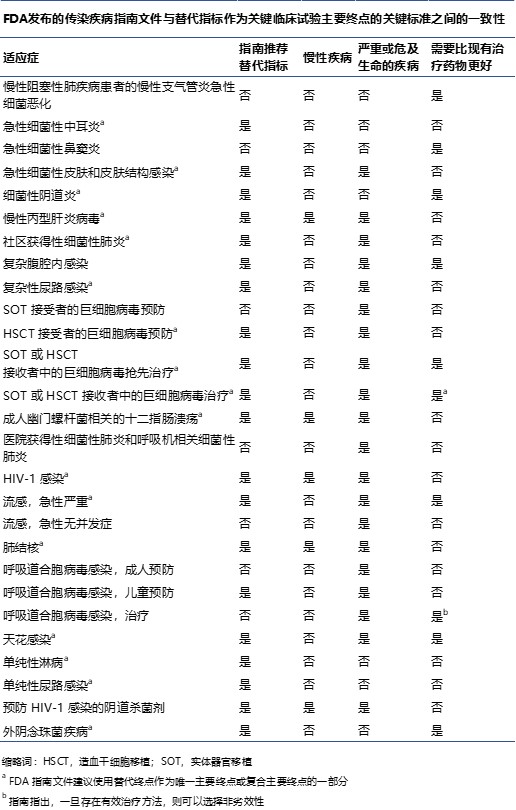
研究人员呼吁 FDA 重新考虑允许使用替代终点的指南
2019.11.16
哈佛大学和乔治华盛顿大学医学院的研究人员于 11 月 12 日在《美国医学会杂志内科学》上发表的一篇评论中指出,美国 FDA 需要在有关开发传染病治疗方法的一些指南文件中重新考虑替代结果的使用。
该评论文章评估了 22 份 FDA 发布的指南文件,包括针对 27 中疾病适应症的关...
|

|
ICH 2019-2020 年指南制定进展更新
2019.11.15
11 月 4 日,加拿大卫生部和美国 FDA 在加拿大渥太华举行 ICH 联合公开咨询会议,两个机构的官员概述了在本月晚些时候即将举行的 ICH 新加坡会议之前 ICH 一些指南所取得的进展。
六个月前,FDA 曾主持了类似的与加拿大的联合公开咨询会议,简要介绍了十几份不同 ICH 指南的...
|
|
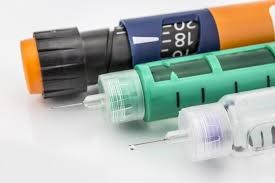
WHO 启动人胰岛素预认证试点程序
2019.11.15
近年来,许多生物治疗产品(BTP)在治疗许多威胁生命的慢性疾病方面已取得成功。2014 年 5 月世界卫生大会(WHA)通过了关于“获取生物治疗产品,包括生物类似治疗产品,并确保其质量、安全性和有效性”的 WHA67.21 号决议。
BTP 是高度复杂的生物药,在某些国家中,根据国际认...
|
|
FDA批准治疗复杂性尿路感染的新抗菌药物
2019.11.14
FDA approves new antibacterial drug to treat complicated urinary tract infections as part of ongoing efforts to address antimicrobial resistance
FDA批准治疗复杂性尿路感染的新抗菌药物,是解决抗菌素耐药性持续努力的一部分
For Immediate Release November 14,...
|

|
FDA批准治疗复发性和难治性套细胞淋巴瘤患者的疗法
2019.11.14
FDA批准治疗复发性和难治性套细胞淋巴瘤患者的疗法,临床试验结果显示肿瘤缩小反应率高
For Immediate Release November 14, 2019
Today, the U.S. Food and Drug Administration granted accelerated approval to Brukinsa (zanubrutinib) capsules for the treatment of a...
|

|
FDA 最新警告信再次显示对缬沙坦供应链前端的关注
2019.11.14
美国 FDA 于 11 月 12 日公布的给 Mylan 公司的警告信再次表明,由于去年发现在某些降血压药的活性药物成分中含有致癌的亚硝胺杂质,FDA 检查员正在将他们的注意力进一步转移至药品供应链上,之前对原料药供应商的关注日益增加,现在焦点已经转向原料药供应商的供应商。
在 Myl...
|

|
识林线下会简报:CAR-T细胞产品的监管路径与合规挑战
2019.11.14
2019年11月11日,识林与Hogan Lovells律所在上海联合举办了主题为“CAR-T细胞产品的监管路径与合规挑战”的线下交流会。君实生物高级副总王刚博士、药明生基医药科技总经理姚树元博士以及Hogan Lovells律所的五位律师出席会议,并为到场的70余位业界人士带来报告,会议由卓见医药联合创...
|

|
FDA 药品质量办公室主任谈改组及评级体系
2019.11.13
美国 FDA 药品质量办公室主任 Michael Kopcha 在 11 月 5 日的 GRx+Biosims 会议上就与质量相关的话题发表演讲,并进一步阐明制药场地评级体系计划。
Kopcha 表示,药品质量办公室(OPQ)内部的改组反映了对药品质量更加有针对性的关注,并敦促仿制药行业采取类似的针对性...
|
|
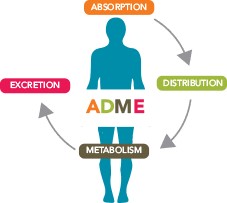
药物吸收代谢研究问题仍是欧洲申报普遍缺陷
2019.11.12
人体内质量平衡研究(human mass balance study)也被称为吸收、分布、代谢和排泄(ADME)研究,是了解新化学实体的药代动力学(PK)特性所需的临床药理学资料包中提供最多信息的研究之一。人体内质量平衡研究中通常包括单剂量和多剂量 PK 研究、相互作用研究(包括食物相互作用)、...
|
|
生物类似药可互换性的价值饱受质疑
2019.11.11
最近普享药协会(AAM)举办的 GRx+Biosims 2019 会议上讨论了许多热点问题,今天我们来看看有关生物类似药方面的话题。行业代表在会上表示,鉴于美国市场的商业动态,在支持可互换性认定的转换研究上投入时间和资源对生物类似药申办人来说可能并不值得。
来自 Sandoz、Mylan 和三星 B...
|

|
【周末杂谈】科学监管:科学家对科学家的交流
2019.11.10
若是仿制药注册申请被拒绝批准,FDA应该在CRL中明确指出应该如何改进注册申请。若文字解释不清的话,FDA应该给申请企业打电话,开展直接的、科学家对科学家的交流(scientist-to-scientist exchange)
昨天的识林资讯报道了前FDA局长Gottlieb医师周三在美国普享药协会(...
|

|
【更新提示】识林一周回顾(20191103-1109)
2019.11.10
【CDE】关于公开征求《已上市化学药品药学变更研究技术指导原则》意见的通知(11.08)
本指导原则主要用于指导药品批准文号/登记号持有人(药品上市许可持有人、药品生产企业,以下简称持有人)开展已上市化学药品的药学变更研究。本指导原则涵盖的变更情形包括:制剂处方中辅料的变...
|

|
FDA 前局长谈促进仿制药竞争等问题
2019.11.09
前美国 FDA 局长 Gottlieb 于 11 月 6 日在普享药协会(AAM)举办的 GRx+Biosims 2019会议上表示,FDA 对风险评估与减轻策略(REMS)滥用等方面的关注可能会促使某些品牌药申办人将策略重点转向商业领域来阻止仿制药竞争进入市场。
Gottlieb 现在已回到私营企业工作,他在...
|

|
识林助力海南药业国际化
2019.11.09
2019年11月7日,海南省医药行业协会、和识林联合举办“海南医药行业国际化认证标准培训”, 200余名药企代表参加了会议。
海南省医药行业协会会长陈益智、副会长李伟、秘书长鲁红出席会议,培训开班仪式由海南省医药行业协会轮值常务副会长仲盛祥主持,培训会由海南省药品监督管理局药...
|
|
FDA批准首例治疗罕见血液病患者的疗法
2019.11.08
For Immediate Release November 08, 2019
Today the U.S. Food and Drug Administration granted approval to Reblozyl (luspatercept–aamt) for the treatment of anemia (lack of red blood cells) in adult patients with beta thalassemia who require regular re...
|
|
FDA 从未检查过的生产场地中四分之一 GMP 不合规
2019.11.08
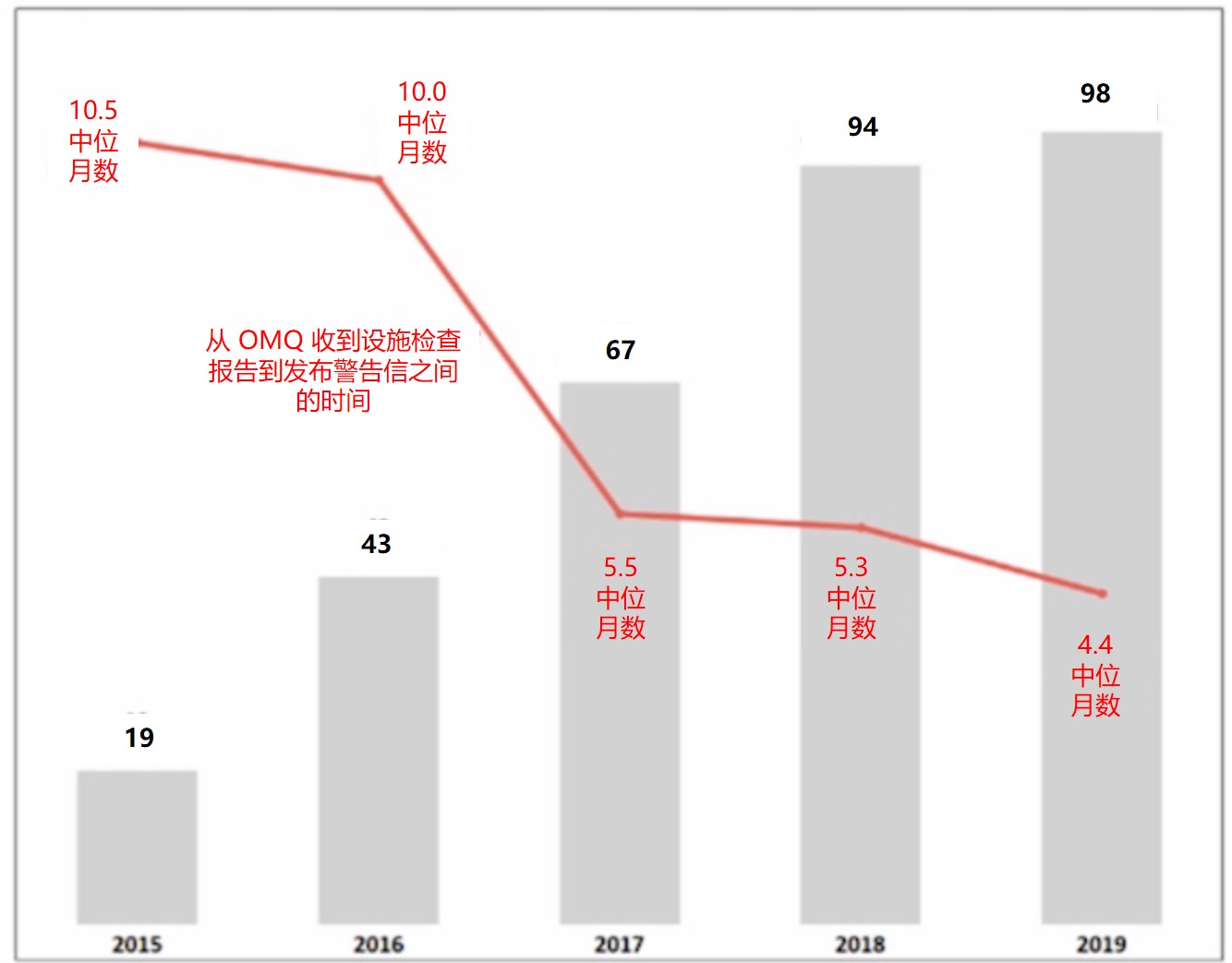
我们在昨天的资讯中介绍了从 2015 财年到 2019 财年,FDA 发出的与生产质量相关的警告信数量激增,从 2015 财年的 19封到 2019 财年的98 封,昨日我们介绍了这些警告信的去向以及警告信周转时间缩短【FDA 警告信数量增加时间缩短,原料药商应注意三大趋势】。今天我们来看看导...
|
|
FDA 警告信数量增加时间缩短,原料药商应注意三大趋...
2019.11.07
美国 FDA 药品审评与研究中心(CDER)合规办公室主任 Donald Ashley 于 11 月 5 日在普享药协会(AAM)会议上对原料药(API)商提出了几项主要关切,指出了与供应链信息混淆、越来越多的数据可靠性问题以及导致召回的杂质问题相关的三大趋势。这些趋势基本与之前的报告类似,详见【FD...
|