
|
临床早期药品生产的 GMP 合规是避免申请被拒的关键
2019.10.22
为避免日益增加的与 GMP 相关的新药批准延迟,企业应更早开始遵守美国 GMP 要求,Covington Burling 律所合伙人 Tom Cosgrove 在 9 月 19 日的 PDA 数据可靠性研讨会上如是表示。他指出,企业应在就 I 期临床研究递交研究用新药申请时就开始遵守 GMP,但目前大多数企业等到...
|

|
FDA 三十年来首次更新 DMF 指南
2019.10.21
美国 FDA 于 10 月 18 日发布《药物主文件(DMF)》指南草案,待最终定稿后该指南将取代 1989 年发布的《药物主文件:指南》。指南基于新的法律、政策和程序,以及与 GDUFA 承诺函相关的程序和电子提交要求,对 DMF 的要求和程序做了许多修改。指南文件还提供了关于指南的新联...
|
|
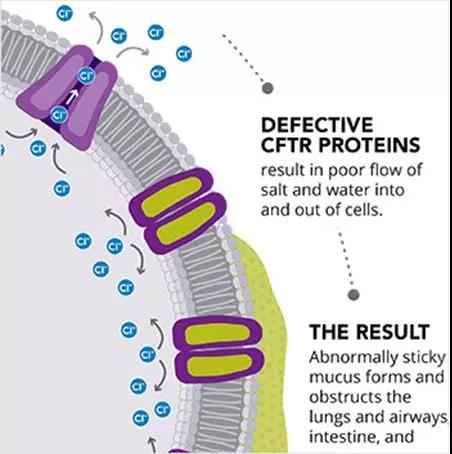
FDA批准治疗囊性纤维化的新突破性治疗 20191021
2019.10.21
The U.S. Food and Drug Administration today approved Trikafta (elexacaftor/ivacaftor/tezacaftor), the first triple combination therapy available to treat patients with the most common cystic fibrosis mutation. Trikafta is approved for patients 12 years...
|

|
【更新提示】识林一周回顾(20191013-1019)
2019.10.20
【FDA】指南草案 药物主文件(10.19)
该指南取代了 1989 年发布的《药物主文件:指南》。基于新的法律、政策和程序,以及与 GDUFA 与 ANDA 承诺函相关的程序和电子提交要求,对 DMF 的要求和程序做了许多修改。指南讨论了 DMF 的使用以及其法律地位和许可过程,概述了 DM...
|
|
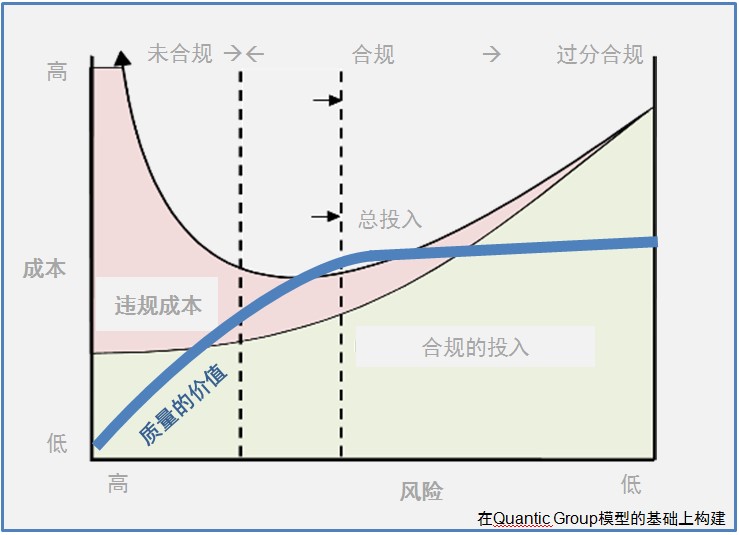
【周末杂谈】药品质量有够吗?
2019.10.20
10月17-18日在北京举行的IPEM年会上,德国默克-雪兰诺公司负责质量的全球高级副总裁Blair Okita博士在题为“质量文化与质量体系”的报告中,给出了一张关于药品质量价值的示意图,着重刻画质量与风险、合规和成本的关系。虽然这些关系也许对很多从业人士并不陌生,但用一张简图将这些关...
|
|
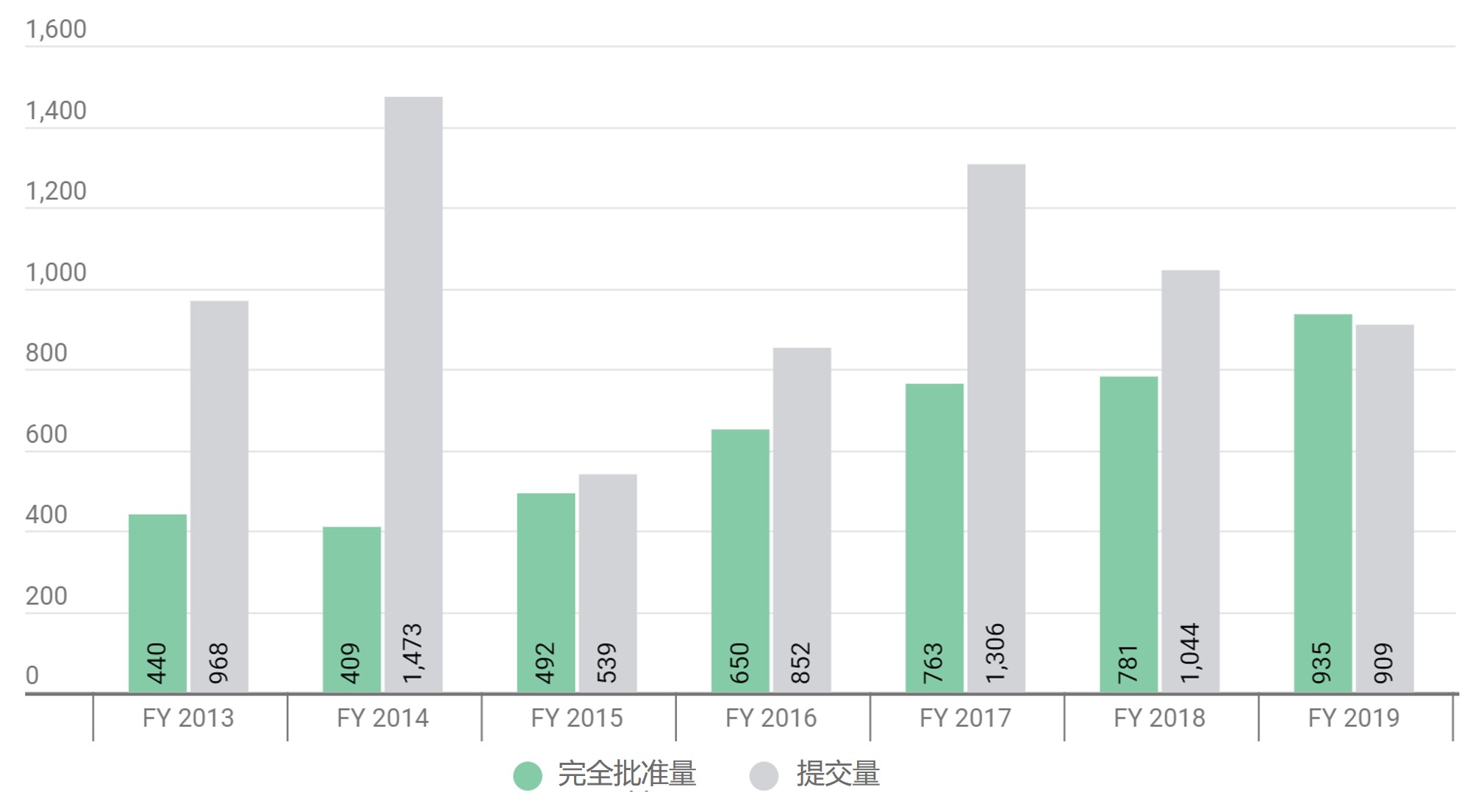
FDA 2019 财年仿制药批准破 900,批准量首超提交量
2019.10.19
2019 财年已经结束,自美国仿制药使用者付费计划(GDUFA)实施以来,这是 ANDA 批准行动数量首次超过提交数量(935 件批准,909 件新 ANDA 提交)。此外,FDA 仿制药办公室(OGD) 2019 财年以 935 件批准的成绩再次打破了批准记录,比 2018 财年 的 781 件批准多出 154 件(...
|

|
欧盟发布有关先进治疗产品的 GCP 指南
2019.10.18
欧盟委员会(EC)于 10 月 16 日根据 2007 先进治疗医药产品(ATMP)法规发布了关于这些复杂和创新产品临床试验质量管理规范(GCP)的新指南。
指南指出,ATMP 是可能会对临床试验的设计和执行提出特定挑战的复杂和创新产品。例如,制造方面的限制和产品的短保质期可能会要求对...
|
|
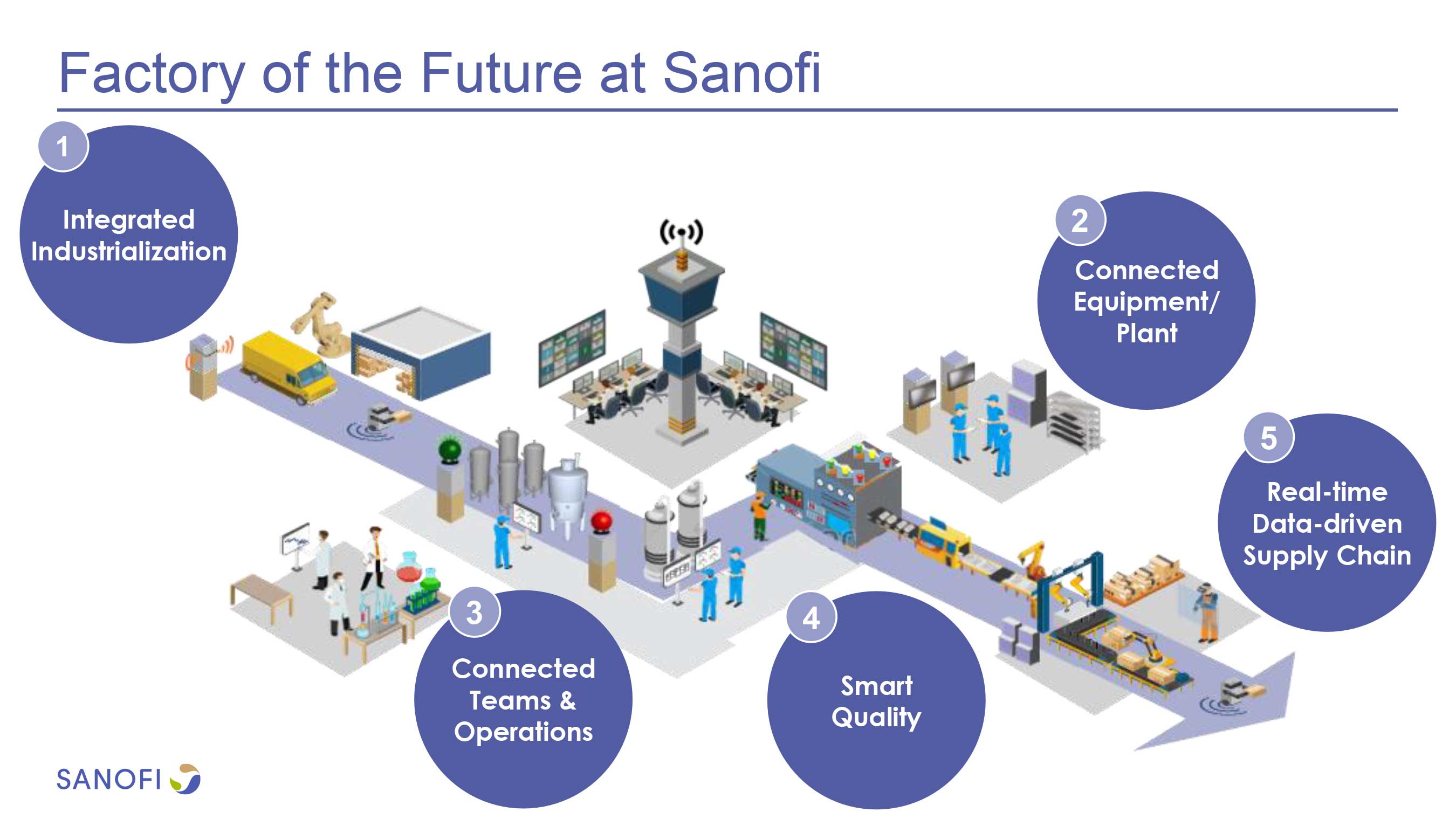
赛诺菲首座数字化连续制造工厂落成
2019.10.17
赛诺菲于 10 月 15 日宣布在马萨诸塞州弗雷明汉(Framingham)市建成一个占地约 9000 平方米的生物制剂工厂,称该厂是其重塑生产基地的关键武器。赛诺菲过去曾一直在测试机器人和新生产方法,最终已将所有这些整合进制造业务。该公司表示,在其弗雷明汉工厂成功生产工艺确认批后,其...
|

|
FDA 对于如何更好开展 OOS 调查的建议
2019.10.16
美国 FDA 持续在 483 和警告信中报告不良超标(OOS)调查,这是 FDA 目前急于解决的问题。FDA 药品审评与研究中心(CDER)合规办公室(OC)高级政策顾问 Brooke Higgins 在 9 月 17 日的 PDA/FDA 联席监管会议上表示,尽管 13 年前(2006 年)就已经发布处理 OOS 调查...
|
|
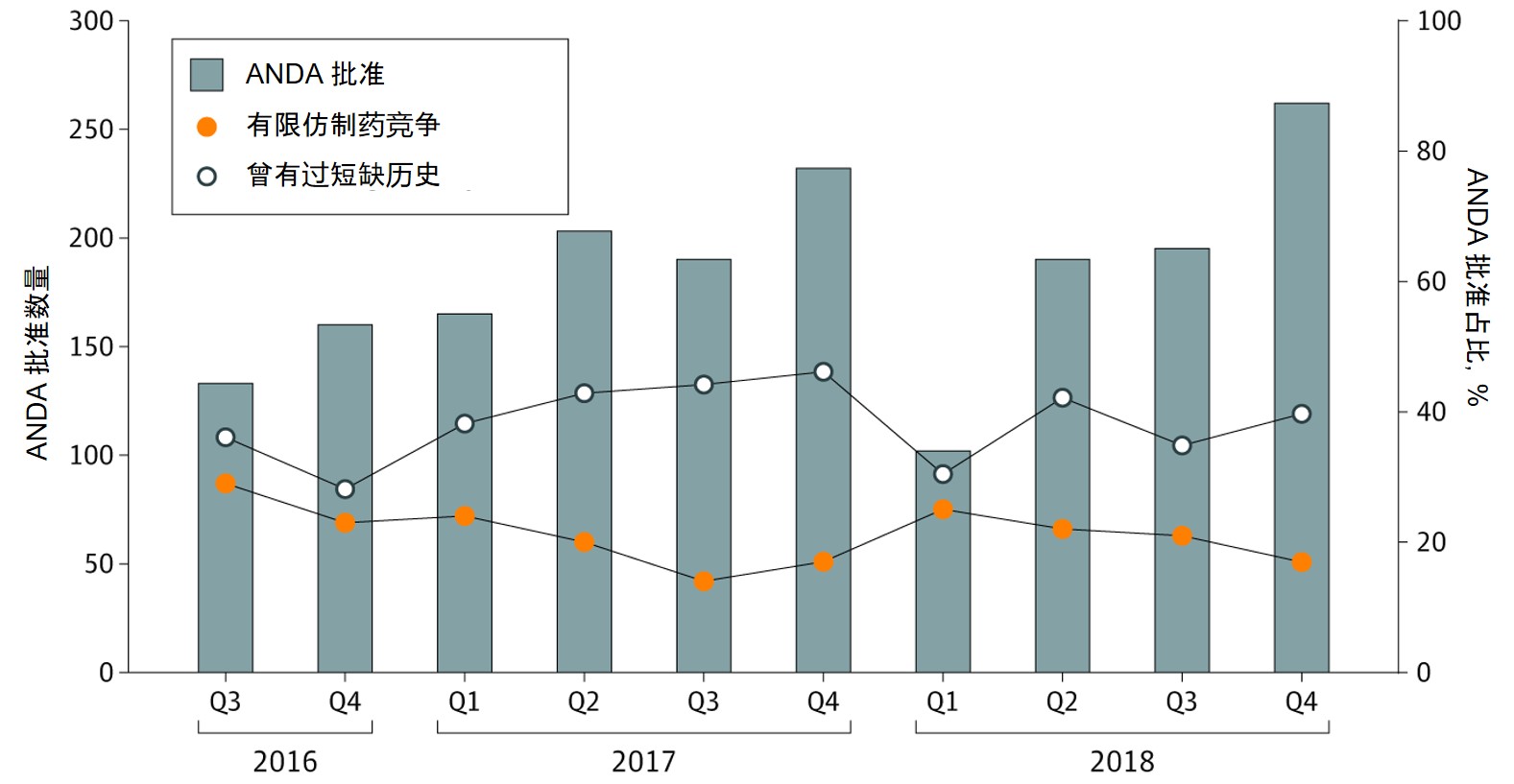
FDA 促进仿制药竞争政策的效果如何?言之过早
2019.10.15
10 月 11 日发表在美国医学会杂志(JAMA)Network Open 上的一篇文章指出,美国 FDA 增加简化新药申请(ANDA)审批的政策对于促进缺乏竞争和易发短缺领域的仿制药发展方面尚未产生明显效果。
FDA 自 2017 年以来采取了一系列行动,包括发布药品竞争行动计划,落实《FDA 重授...
|
|
FDA 关于雷尼替丁中 NDMA 杂质情况的问答
2019.10.14
继去年夏天在沙坦类降压药中检出含有致癌性的亚硝胺类杂质(包括 NDMA 等)之后,今年 9 月初,又在治疗胃灼热的雷尼替丁中发现同类杂质,受影响的产品中包含已广泛使用数十年的品牌药善胃得(Zantac)。事件仍不断发酵,各类报道的不断,令患者感到惶恐,对于监管机构的信心也有所动摇...
|
|
雷尼替丁中亚硝胺杂质问题的 FDA 进展梳理
2019.10.14
美国 FDA 于 10 月 11 日在网站上公布了关于雷尼替丁中 NDMA(N-亚硝基二甲胺)杂质的问答,以简短明了的语言回答了公众目前最为关心的问题,包括雷尼替丁是否都被召回了,为什么被召回,是否应停药,安全替代品有哪些等等。
雷尼替丁是一种 H2(组胺-2)阻滞剂,可减少胃产...
|

|
【更新提示】识林一周回顾(20191006-1012)
2019.10.13
【国务院】关于进一步做好短缺药品保供稳价工作的意见(10.11)
【国务院】印发关于进一步做好短缺药品保供稳价工作的意见(10.11)
在保供方面,一是加强协同监测。二是做好短缺药品清单管理。三是实施短缺药品停产报告。四是落实直接挂网和自主备案采购政策。五是建立健全短缺...
|

|
【周末杂谈】毒性杂质与仿制药企的可怜
2019.10.13
人们常说,新药的价格是由疗效决定的,且有堂堂药物经济学作证。但不知什么药物经济学支持新药每年涨价15%1,且连续多年(只要专利没过期)?要知道,虽然价格年年涨,但药可是从没有变过,而且总是称新药。也许有人会说,苹果手机价格也年年涨啊?但手机可是一年一个型号,功能逐年增加...
|

|
亚硝胺杂质事件引发监管部门思考质量范式转变
2019.10.12
接连在某些成熟的降压和抗酸药物中发现致癌性亚硝胺杂质意味着制药公司并不完全了解其产品。此类事件应引起监管机构的警觉,重新审视其老旧的质量评估模型,并转变药物杂质鉴定方法。这是 9 月 30 日至 10 月 2 日在爱尔兰都柏林举行的监管事务专家组织(Organisation for Professional...
|

|
2019 IPEM 年会(二轮通知)
2019.10.12
合理监管 Regulate Sensibly ,科学研发 Develop Scientifically ,高效生产 Manufacture Competitively ,尽责管理 Manage Responsibly
大家好,
与首轮通知相比,会议第二天上午提早半小时开始,下午取消了一次间歇,目的是增加报告和问答讨论时间。在拿到Marten Ritz和Bla...
|

|
FDA 三大中心主任讨论:药品批准标准是否过于宽松?
2019.10.11
从行业到学术界很多批评者都认为美国 FDA 的药品批准标准正在不适当地变低,并且所要求的批准后评估要么不充分,要么已被取消。但在 10 月 7 日在预见政策(Prevision Policy)和癌症研究之友(Friends of Cancer Research)主办的第五届生物制药大会上,三位 FDA 主任提出了反对...
|

|
ISPE 与 PDA 联合发布根本原因分析指南改善企业质...
2019.10.10
国际药物工程学会(ISPE)和非肠道药协会(PDA)于 10 月 7 日联合发布根本原因分析指南,以通过提供有关工具、技术和过程方面的建议来帮助制药业改善质量文化。
双方还于当天宣布签署了一项谅解备忘录(MOU),以交流有关各自在质量量度和质量文化方面工作的信息。根据 MOU,双方...
|

|
WHO 发布 2019 抗生素分类数据库加大力度应对耐药...
2019.10.09
世界卫生组织(WHO)于 10 月 1 日宣布已上线最新版本的 AWaRe 抗生素分类数据库,该数据库是一种管理工具,供各国政府在制定有关处方和监测抗生素政策时使用。
WHO 表示,该数据库不仅可以被政策制定者用来“支持制定绩效目标并指导各国对抗生素的最佳使用”,还可以被临床医生...
|

|
GDUFA 绩效报告显示仿制药审评时间有所改善
2019.10.08
美国 FDA 于 9月初发布了其递交给国会的 2018 财年仿制药使用者付费计划(GDUFA)绩效报告,报告中显示 GDUFA I 期(2013 财年-2017 财年)仿制药申请批准时间显著减少,反映了 FDA 和申办人在精简审批流程、完善申请资料方面的努力。
从 2013 财年到 2017 财年,ANDA...
|