
|
FDA 发布 2019 年药品相关指南的制定计划
2019.03.08
美国 FDA 药品审评与研究中心(CDER)于 3 月 5 日发布其 2019 年药品方面的指南制定计划,计划发布 93 篇新增和修订指南草案,涵盖从生物类似药、仿制药到临床药理学和药品安全 15 个类别。下面我们来看看这份清单的重点内容。
生物类似药方面,FDA 计划发布《支持对治疗...
|

|
FDA 两篇有关新药申请中生物利用度和食物影响研究的...
2019.03.07
美国FDA在2月25日发布了两篇新的指南草案,《NDA或IND的体内生物利用度(BA)研究一般考虑》和《IND和NDA中评估食物对药物的影响 — 临床药理学考虑》。两份草案涉及了人体对药物的吸收问题,以及食物对药物疗效的影响。
FDA局长Scott Gottlieb表示,“准确的药品配方有很多因素,可...
|

|
FDA 局长 Scott Gottlieb 将辞职
2019.03.06
据华盛顿邮报 3 小时前的消息,美国 FDA 局长 Scott Gottlieb 将在一个月内辞职。
Gottlieb 自 2017 年 5 月起担任 FDA 局长。他在辞职信中写道“在过去的 23 个月中,我很荣幸能够与 FDA 一支优秀团队在一起工作,并与专业人员合作实施许多有意义的激励措施,推动公...
|

|
FDA 药品质量办公室 2018 年度报告全文翻译
2019.03.02
美国 FDA 药品质量办公室(OPQ)于 2 月 28 日发布 2018 年度报告,这是自去年来发布的第二份年报,仍然是图文并茂并在每页列出关键点,易于阅读。报告整体与去年相比,更加简洁,更加面向普通大众,也就是患者、医生。报告中有关 OPQ 去年成就和绩效的部分更加精简,多以关键数...
|

|
FDA 仿制药办公室发布 2018 年报
2019.03.01
美国 FDA 仿制药办公室(OGD)于 2 月 27 日发布 2018 年度报告(pdf
url=https//www.fda.gov/Drugs/ResourcesForYou/Consumers/BuyingUsingMedicineSafely/GenericDrugs/ucm631710.htm),这是其发布的第四份年报。一如既往的总结了仿制药办公室在过去一年中的所...
|
|
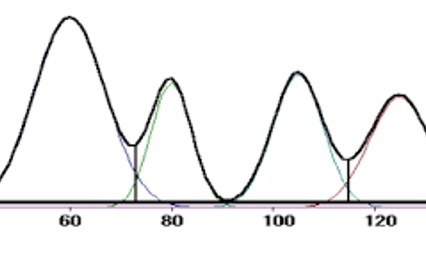
WHO 良好色谱实践亮点分析
2019.02.27
2月21日,WHO发布了良好色谱实践(Good Chromatography Practices)征求意见稿文件,这是非常有意义的、专门适用于色谱的良好实践。为更好的理解该文件,我们收集了安捷伦公司专家对于文件的点评,并在此基础上对于文件的特色部分做了亮点分析。
安捷伦大中华区液相产品应用经理陈波...
|

|
FDA 发布 22 篇新 BE 指南和 52 篇修订指南
2019.02.26
美国 FDA 于 2 月 22 日发布了一批 74 篇具体产品生物等效性(BE)指南,其中 22 篇新增,52 篇修订。
这些指南中针对复杂药品的有 4 篇新增指南和 45 篇修订指南,其中包括 16 种目前尚无仿制药获批的产品。总共有 35 篇指南是针对尚无获批仿制药的产品。另外,有 ...
|
|
FDA 再生医学疗法加快程序定稿指南解读
2019.02.23
美国 FDA 于 2 月 15 日发布《适用于严重疾病的再生医学疗法的加快程序》定稿指南,澄清了在临床试验中可能会考虑历史对照,申办人可以为一个给定产品请求并获得一个以上的加快程序认定,以及对于产品的生产变更不一定会阻碍最初的再生医学先进疗法(RMAT)认定或导致 RMAT 认定被...
|

|
FDA 启动有关药品质量的“既定条件”试点计划
2019.02.19
美国 FDA 于 2 月 14 日宣布了一项新的试点计划,以测试在药品申请质量评估中的“既定条件(Established Conditions,EC)”概念。该试点的目的是让 FDA 在评估拟议既定条件方面获得实践经验,并确保评估决策不会对使用者付费时间框架产生负面影响。EC 是“为保证获批产品的工艺...
|

|
FDA 发布竞争性仿制药指南草案
2019.02.18
美国 FDA 于 2 月 15 日发布《竞争性仿制药》指南草案,介绍了 2017 年《FDA 再授权法案》(FDARA)第 506H 条的新法定要求。竞争性仿制药(CGT)的颁布是为了促进和激励研发,加快对某些仅有很少或没有竞争的已获批药品的仿制药的审批。此外,在某些情况下,这些法律条款的激...
|

|
FDA 发布组合产品上市前路径原则指南草案
2019.02.09
美国 FDA 于 2 月 5 日发布《组合产品上市前路径原则》指南草案,提供了 FDA 关于组合产品上市前审评原则的当前考量,包括指导申请人针对自身产品应选择哪种上市前提交类型。指南提供了与组合产品相关的一般性、高层级的信息。
FDA 发布该指南草案是作为实施《21 世纪医药法...
|

|
ICH 正式发文计划协调仿制药标准
2019.02.08
ICH 于 2 月 6 日发布了一份思考性文件(reflection paper),概述了关于跨国协调仿制药技术和科学标准的思考。
该文件建议对非复杂制剂和复杂制剂制定一系列证明生物等效性标准的 ICH 指南。文件还介绍了将于 2019 年组建的非正式仿制药讨论组(Informal Generic drug Discussion...
|

|
Advair 吸入器首款仿制产品获 FDA 批准
2019.01.31
美国 FDA 于 1 月 30 日批准了 Mylan 公司首个 Advair 仿制产品。Advair 是 GSK 公司研发的重磅哮喘治疗药械组合产品(丙酸氟替卡松和沙美特罗吸入粉剂)。Mylan 的仿制产品每日两次用于治疗 4 岁及以上患者的哮喘以及气流阻塞的维持治疗并减少慢性阻塞性肺病(COPD)患者...
|

|
FDA 首次提供非处方药纳洛酮标签模板
2019.01.29
美国 FDA 通过史无前例地开发药品事实标签(Drug Facts Label,DFL)模板,表达了其对于通过非处方(OTC)途径直接提供纳洛酮来用于阿片类药物过量治疗的兴趣。潜在的非处方纳洛酮申办人可以使用 DFL 模板开展其自己的标签理解研究。
药品事实标签(Drug Facts Label,DFL)...
|

|
FDA 发布加速审批药品说明书的定稿指南
2019.01.28
美国 FDA 于 1 月 22 日发布《加速审批监管路径下批准的人用处方药和生物制品说明书》定稿指南(中文翻译),指南对于替代终点被广泛认可的治疗领域(例如,肿瘤学领域)以及那些替代终点没有被很好地了解的治疗领域分别给出了具体的说明书建议。
指南指出,对于像抗癌药等一些药...
|

|
欧洲药品管理局总部将于 3 月初搬迁至荷兰阿姆斯特...
2019.01.26
欧洲药品管理局(EMA)将在2019年3月初搬迁至荷兰。荷兰当局已经在2019年1月9日将位于阿姆斯特丹Sloterdijk镇的临时性建筑“Spark”大厦正式移交给EMA的执行董事Guido Rasi。EMA现在正在准备正式搬迁。搬迁期间,EMA必须同时确保其主要监管活动的继续进行,并相应的启动其“业务连续性...
|
|
制造环节:细胞与基因疗法面临的下一个大挑战
2019.01.24
随着新型细胞与基因疗法的管线和市场的扩展,药品研发商是时候关注物流链条其它关键方面的问题了:对于复杂的细胞与基因疗法,制造环节成为行业面临的下一个大挑战。随着从较小规模的临床试验转向更大规模的临床试验,接着进行规模化生产实现商业化,受制于载体供应,病毒载体制造可能成为...
|

|
欧盟行业协会发布生物制品原辅料风险管理指南
2019.01.23
欧盟一家代表生物制药商的行业协会(European Biopharmaceutical Enterprises,EBE)于去年 12 月 17 日发布了一份题为“生物医药产品和先进治疗医药产品(ATMP)生产中使用的原辅料的管理与控制”和 ATMP 制造商为在这些产品中使用的原辅料制定风险评估计划。该文件还旨在提高供...
|

|
FDA 发布关于暂时批准 ANDA 的重要指南
2019.01.19
美国 FDA 于 1 月 16 日发布了一份题为《ANDA 递交 – 暂时批准 ANDA 的最终批准增补和请求》。这是 FDA 首次在联邦公报公布之前发布指南,FDA 在介绍指南发布的消息中附有一条说明:
“我们在 FDA 网站上发布该文件,因为该文件目前无法在联邦公报(FR)通告上公布。...
|

|
识林年度回顾:2018 具体产品 BE 指南
2019.01.17
FDA 在2018年度发布的 BE 指南
2018年度,FDA发布了7次产品BE指南的新增和修订,总共新发布128个产品BE指南,并对117个产品的BE指南进行了修订。
1. 阿片类药品的 BE 修订,增加“防止滥用”试验
FDA指南“评估口服固体阿片类药物仿制药的防滥用措施的一般原则”(General Principle...
|