|
药品运输验证探讨
2019.09.09
不知大家想过没有:患者与医生或药品经销商之间的最后连结点在哪里?不是负责发药的药剂师而是药品包装。药品包装是至关重要的,此外,在整个药品供应链中,包装可以保护药品免受外部影响和异物侵害,此外,在药品保质期内,包装有助于在各种环境条件下确保药品始终如一的保持产品标签上的...
|

|
【更新提示】识林一周回顾(20190901-0907)
2019.09.08
【IPEM】2019 IPEM年会(09.05)
2019 IPEM年会将于 2019 年 10 月 17-18 日在北京大学中关新园1号楼 科学报告厅举办。年会采用新形式,一是报告少而深,二是特色讲座,三是兴趣组活动。两天的会议总共只有五位报告人。每人有60-90分钟报告及30分钟讨论时间。年会通过学习和交...
|
|
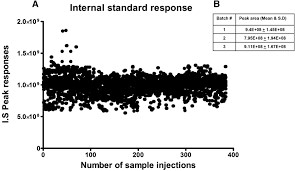
FDA 色谱分析数据中内标响应变异性的问答指南
2019.09.07
美国 FDA 于 9 月 4 日发布了一份问答定稿指南,向申办人、申请人和合同研究组织提供有关色谱分析数据中内标(IS)响应变异性的建议。这份指南由 FDA 药品审评与研究中心(CDER)下的研究诚信和监督办公室、仿制药办公室和临床药理学办公室共同制定。
此类色谱分析数据可能在研...
|

|
FDA新版批准前检查手册精华导读 I:商业化生产准备就...
2019.09.06
2019年8月13日,FDA发布了新版《批准前检查手册》(CPGM 7346.832 Pre-Approval Inspections-Investigations),合规项目指南手册(Compliance Program Guidance Manual,CPGM)为 FDA 人员评价企业合规性活动时提供指导,是FDA指导检查员的工作手册,其中包含了对FDA检查员...
|

|
2019 IPEM年会
2019.09.05
合理监管 Regulate Sensibly ,科学研发 Develop Scientifically ,高效生产 Manufacture Competitively ,尽责管理 Manage Responsibly
2019 IPEM年会
北京大学中关新园1号楼 科学报告厅 2019年10月17-18日(周四-周五)
鸣谢:IPEM顾孝诚基金,IPEM 课...
|

|
从警告信看 FDA 对 OTC 生产商的四个关注重点
2019.09.05
美国 FDA 最近向非处方药(OTC)和保健产品生产商发出的一连串警告信显示了与 GMP 和质量管理监管期望相关的相似缺陷。
这些警告信中反复出现的许多基本问题表明了质量管理体系(QMS)的潜在不足之处。其中包括由于管理不善以及缺乏合适的经验证的检测所导致的微生物污染,生产操作...
|
|
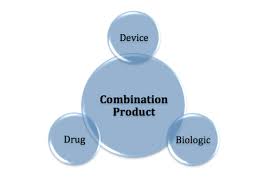
组合产品上市后 CDMO 策略
2019.09.04
组合产品公司应如何监控产品、工艺或监管变化带来的影响?
应采用哪些技术文件和支持程序来开展有效的上市后产品管理?
如何管理诸如纠正和预防措施(CAPA)、投诉和变更控制等上市后问题?谁负责评估这些系统,如何对多个供应商进行管理?
本文针对的是那些已有组合产品上市或者正...
|

|
FDA 境外检查数量增加,执法行动比率更高
2019.09.03
昨天我们介绍了“海边 GMP”年会上美国 FDA 对于拥有成熟质量体系的重视【FDA 关于质量体系成熟度十大标志的建议 2019/09/02】,今天我们结合 FDA 发布的检查信息来看看此次会议上报告的 FDA 合规检查情况和一些统计数据。
药品方面
FDA 统计数据显示,尽管 FDA 药品审评...
|
|
FDA 关于质量体系成熟度十大标志的建议
2019.09.02
8 月 12 -14 日在美国马里兰州 Cambridge 举行的“海边 GMP”年会上,美国 FDA 的合规部门鼓励制药公司确保他们展示“质量成熟度”,并提供有关 FDA 希望看到的具体内容。FDA 对于成熟质量体系的建议既适用于初创公司也适用于老牌制药商和申办人,既适用于制药企业也适用于医...
|

|
【更新提示】识林一周回顾(20190825-0831)
2019.09.01
【NMPA】关于发布《药品追溯系统基本技术要求》等3项信息化标准的公告(2019年第67号)(08.28)
为贯彻落实《中华人民共和国疫苗管理法》规定,按照《关于药品信息化追溯体系建设的指导意见》(国药监药管〔2018〕35号)等文件要求,国家药监局组织制订了3项信息化标准:《药品追溯系...
|

|
WHO 启动人类基因组编辑研究全球登记
2019.08.31
世界卫生组织(WHO)于 8 月 29 日宣布启动人类基因组编辑研究全球登记,同时对于人类基因组编辑治理在线征询意见。
WHO 在去年 11 月份贺建奎宣布一对广受争议的基因编辑女婴降生后宣布组建新专家委员会,委员会于今年二月正式成立,于三月份举行了首次会议,呼吁为所有人类基...
|

|
FDA 综合审评文件因丢失大量宝贵信息遭联名反对
2019.08.30
来自哈佛大学、耶鲁大学、约翰霍普金斯大学以及世界其它大学的 50 多名学者和研究人员呼吁美国 FDA 不要用综合审评(integrated review)取代其对医药产品的原始审评,因为综合审评文件将会丢失很多有价值的信息。
FDA 于 6 月 27 日公布了两份综合审评文件样本并公开征求意见。...
|

|
原辅料元素杂质额外要求造成 FDA ANDA 审批延迟
2019.08.29
辅料供应商抱怨美国 FDA 对于辅料和原料药生产商检测物料中元素杂质的要求已经超出 ICH 和 USP 的要求,并且延迟了批准。
美洲国际辅料协会(IPEC-美洲)前任主席、杜邦营养和生物科学全球法规事务经理 Priscilla Zawislak 在 8 月 21 日 IPEC-美洲举行的网络研讨会上表示,...
|

|
英国议会与患者组织呼吁严惩不披露临床试验数据者
2019.08.28
英国下议院科学技术委员会主席 Norman Lamb 再次呼吁英国卫生研究局(HRA)惩治不遵守临床试验报告要求的申办者和研究者。
上周,12 个患者权益倡导组织联名向 Lamb 发信,呼吁 Lamb 向 HRA 写一封公开信,提醒 HRA 有关议会对于不遵守临床试验报告要求的惩治期望,并鼓励 H...
|

|
连续制造深陷泥潭,如何改变现状?
2019.08.27
连续制造一直以来是讨论热点,监管机构大力提倡,企业存有顾虑,技术、成本和监管批准上都面临着种种挑战。8 月 2 日在线发表在《药物科学杂志》(Journal of Pharmaceutical Sciences)上的一篇文章“连续制造的动因及如何实现:国际连续制造学术研讨会综述”(Why We Need Continuous...
|

|
新修订药品管理法表决通过,附答记者问摘录
2019.08.26
摘要:
1. 对药品管理法的全面修改体现了“四个最新”。
2. 鼓励药物创新方面的举措。
3. 上市许可持有人制度。
4. 儿童用药。
5. 药品追溯制度。
6. 未经批准进口的药品,网上售药。
7. 最严厉处罚。
8. 与疫苗法的衔接。
今日上午(2019 ...
|

|
研究显示 EMA 和 FDA 在批准决策方面高度一致
2019.08.26
根据一项最新研究对欧洲药品管理局(EMA)和美国 FDA 在 2014 年至 2016 年间 107 件申请的分析显示,两家机构对超过 90% 的申请做出了同样的决策。这项 7 月份发表在《临床药理学与治疗学》杂志上的研究是两家机构间开展的首项此类研究。
研究者表示,EMA 与 FDA 之间...
|

|
【更新提示】识林一周回顾(20190818-0824)
2019.08.25
【全国人大】新版药品管理法修订草案:鼓励连锁经营,加强网售监管(08.23)
【全国人大】新版药品管理法修订草案:药品审评审批更加严格(08.23)
【全国人大】新版药品管理法修订草案:鼓励中药传承创新(08.23)
【全国人大】新版药品管理法修订草案:假药劣药范围...
|

|
病毒和细菌:新一代护肤品?
2019.08.24
痤疮治疗市场同时存在过饱和与治疗欠缺的情况。当然皮肤护理市场有各种支柱品牌和功能性产品,同时还有一些需要去皮肤科医生那里通过处方才能获得产品,例如仿制维甲酸和抗生素。但有一天痤疮治疗可能会有新选择:细菌和病毒。
随着科学家们发现有关皮肤微生物组的更多细节,小型初创公...
|
|
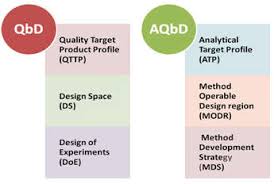
MHRA 分析质量源于设计(AQbD)问答
2019.08.23
本月末,英国药品与医疗保健产品监管机构(MHRA)就将分析质量源于设计(AQbD)原则应用于药典标准向公众的反馈意见征询期将截止。【英国 MHRA 就分析质量源于设计公开征询意见 2019/06/13】现在我们来跟随 MHRA 博客对英国药典的两位药典科学家 Stephen Maddocks 和 Peter Crow...
|