
|
FDA 警告意大利医疗器械环氧乙烷灭菌公司,涉嫌伪造...
2021.06.05
美国 FDA 于 6 月 2 日在给医疗器械制造商的一封https//www.fda.gov/medical-devices/industry-medical-devices/sterility-issues-medical-devices-processed-steril-milano-facilities-letter-industry?utm_medium=email&utm_source=govdelivery 公开信中表示...
|
|
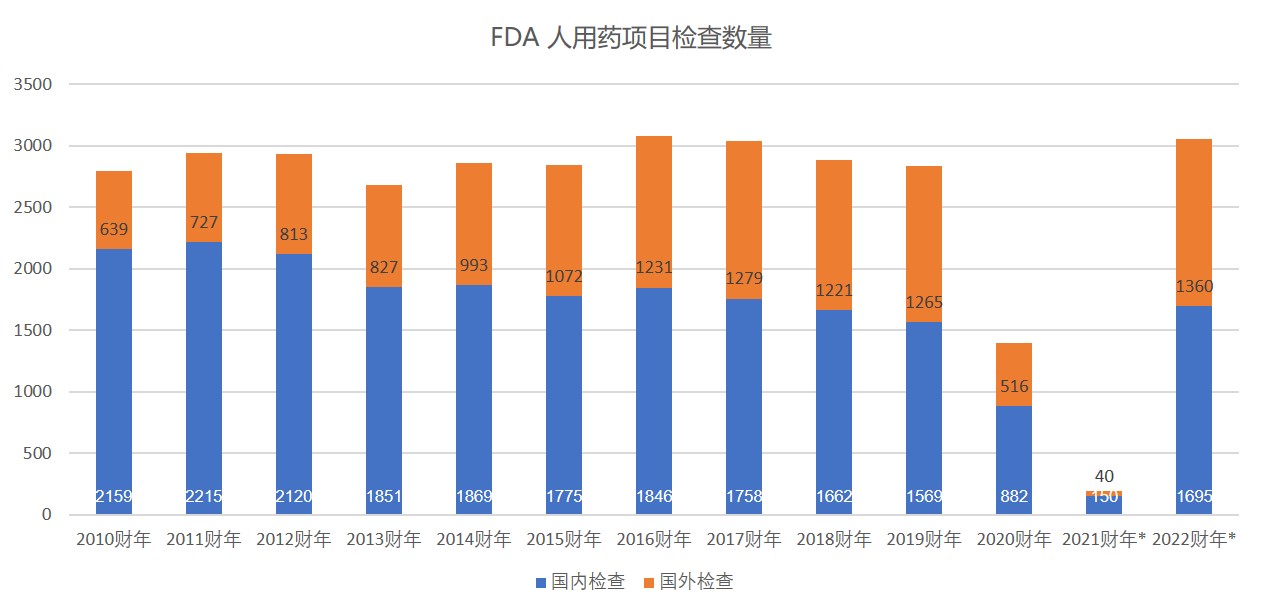
FDA 2022 财年预算申请再加码,为检查计划要人要钱...
2021.06.04
美国 FDA 的药品生产设施检查预计将在 2022 财年大幅增加至更正常的水平,但可能需要额外资金来应对新冠疫情造成的积压。
FDA 在 2022 财年总共申请了 65.3 亿美元,包括 36.1 美元的预算授权和 29.2 亿美元的使用者付费收入。总额比国会为 2021 财年颁布的预算总额增加 ...
|
|
FDA 发布四份有关药品供应链安全问题的指南草案
2021.06.04
美国 FDA 于 6 月 3 日发布了四份指南草案和定稿指南,帮助申办人更好地理解《药品供应链安全法案》(DSCSA)某些方面的条款和条件,下面我们一一来看看:
《药品供应链安全法案》下从核实义务角度对可疑产品和非法产品的定义 — 这是基于收到的反馈意见对 2018 年 3 月发...
|

|
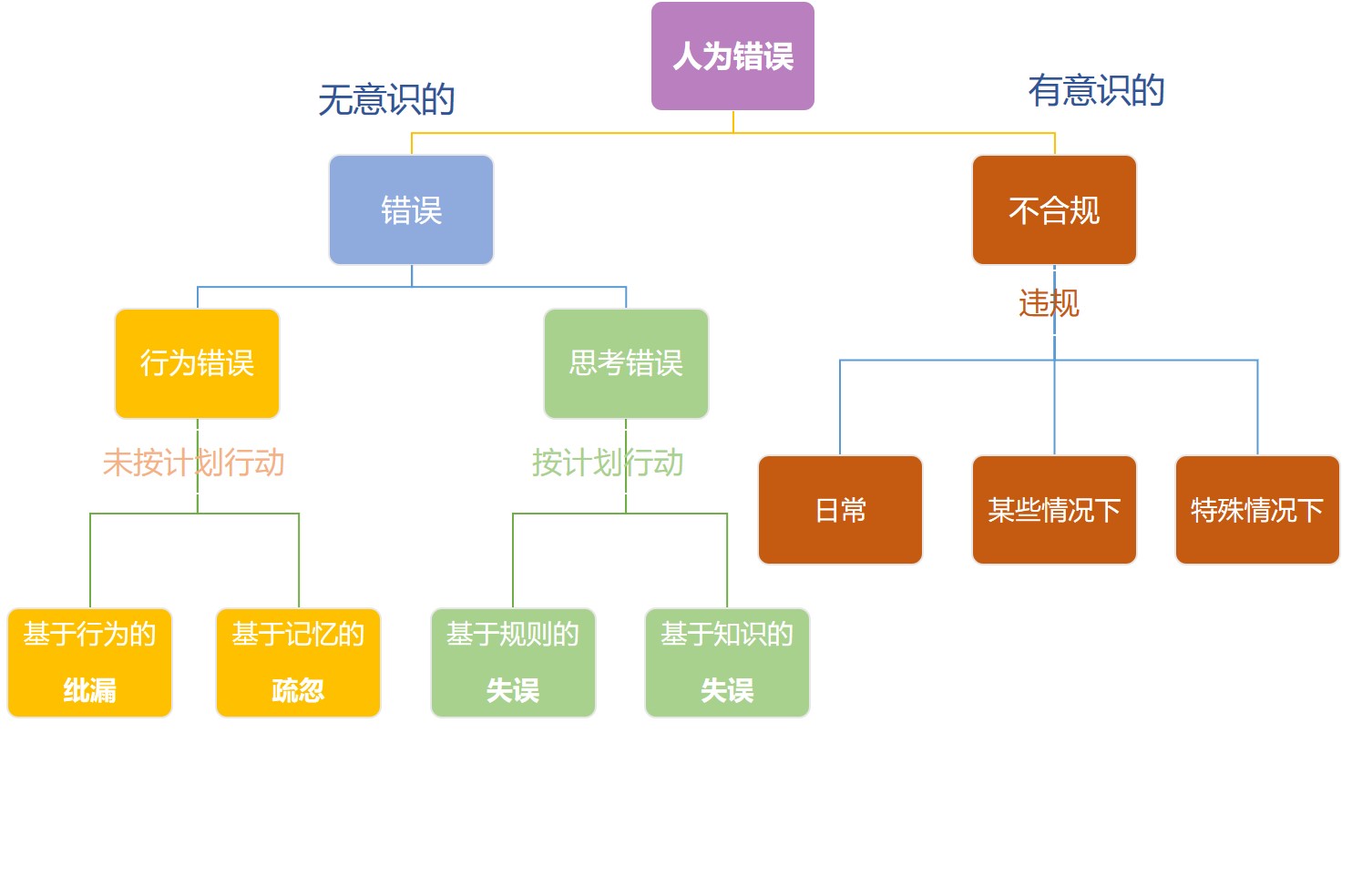
人为错误管理:降低复杂性,简化简化再简化
2021.06.03
前两天,我们在【人为错误:细分、管理原则及常见陷阱】一文中介绍了对人为错误的分类和管理方面的一些建议,其中有一条用结构化和主动的方式减少错误,设计不当的活动更容易出现人为错误。
在之前的文章【CMO混淆污染致1500万剂新冠疫苗报废:人为错误不能怪人】中,在制药行业有着 3...
|

|
渤健阿尔茨海默药 FDA 判决日期临近,资本市场发出...
2021.06.03
美国 FDA 将于 6 月 7 日就渤健(Biogen)的 aducanumab 做出决定。如果获得批准,将成为二十多年来第一个上市的阿尔茨海默症治疗方法。【FDA 推迟对渤健阿尔茨海默药的审批决定 2021/01/30】
而如果被拒,可能会对这家总部位于马萨诸塞州的公司产生深远影响。根据 Insightia 发布的...
|

|
科兴新冠疫苗列入 WHO 紧急使用清单,成为第二款进...
2021.06.02
国内时间 6 月 1 日晚 11 点多,世界卫生组织(WHO)总干事谭德赛宣布,中国科兴生物的灭活新冠疫苗 CoronaVac(克尔来福)通过技术审评,被列入紧急使用清单(EUL)。继 5 月 7 日国药集团中国生物北京生物制品研究所的新冠疫苗之后,成为第二款进入 WHO EUL 的中国新冠疫...
|
|
FDA Optimus 项目鼓励现代癌症治疗药摆脱传统剂量探...
2021.06.02
美国 FDA 肿瘤卓越中心的最新项目将研究更好地肿瘤产品剂量优化策略,以及如何实施这些策略。FDA 肿瘤疾病办公室医学肿瘤学家 Mirat Shah 在 5 月 20 日美国癌症研究协会年会的癌症监管小组讨论上介绍了这一项目。
Shah 没有给出关于“Optimus 项目(Project Optimus)”...
|
|
人为错误:细分、管理原则及常见陷阱
2021.06.01
我们在之前【CMO混淆污染致1500万剂新冠疫苗报废:人为错误不能怪人】一文中讨论的调查人为错误的一些注意事项,引发了读者的广泛关注。今天,我们来看看英国职业健康与安全管理局(HSE)对人为错误的分类和管理方面的一些建议。
无论培训情况如何、人员积极性如何,每个人都可能犯错误...
|

|
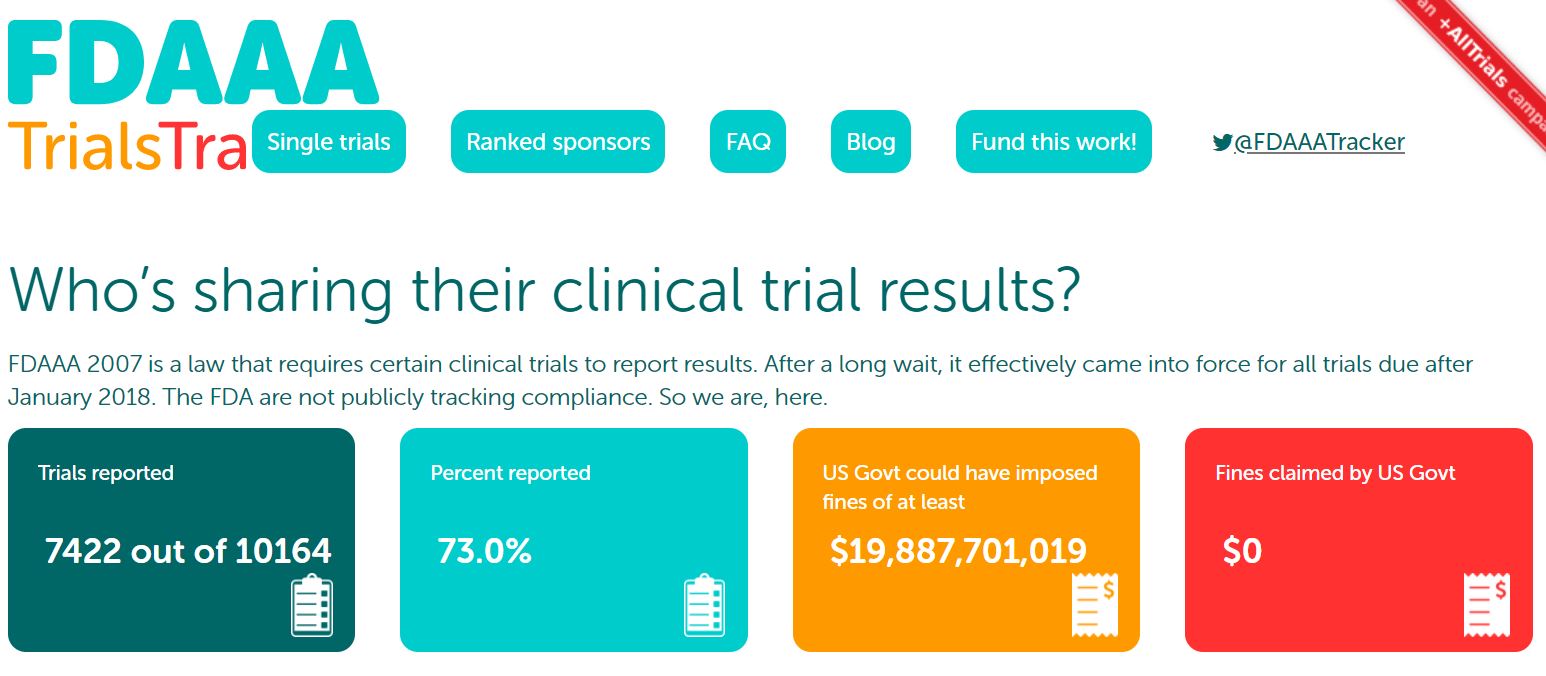
临床试验结果公开初现成效?大多数临床试验仍未能及时...
2021.06.01
随着提高临床试验透明度的呼声不断增加,一项新的分析发现,只有 40% 的研究结果在规定的一年期限内报告给了美国临床注册库 ClinicalTrials.gov。
根据 5 月 24 日发表在《美国医学会杂志·内科学》上的一篇分析1显示,除临床试验结果的报告率较低外,申办人较好地遵守了其它要求...
|

|
【一周回顾】2021.05.24-05.30
2021.05.31
国家知识产权局发布修改后专利法的相关审查业务处理暂行办法,国务院发布修订后专利法实施相关问答。总局发布药品检查管理办法(试行)。FDA 发布双特异性抗体研发项目定稿指南,更新新冠疫苗紧急使用授权指南。英国批准强生单剂新冠疫苗。
上周热点资讯:
临床试验结果公开:三年...
|

|
FDA 或将公开药品生产场地远程评估结果,组建新委员...
2021.05.31
美国 FDA 正在考虑公布其对药品生产场地的远程交互式评估的结果,新的 FDA 检查活动委员会将为 FDA 的检查项目制定行动计划。
FDA 监管事务办公室负责医药产品和烟草业务的助理局长 Elizabeth Miller 在 5 月 19 日食品和药品法律研究所年会上表示,“为了透明起见,FDA...
|

|
【周末杂谈】FDA 应只管安全性,不管有效性?
2021.05.30
听听有关改革药品监管和相关政府角色的一些极端声音
2012年2月,卸职才三年的前FDA局长von Echenbach医学博士以“FDA的药品审批应基于安全性,有效性应留给上市后研究”为题在华尔街日报撰文,主张改革药品监管,从而达到鼓励创新、降低药价、造福患者的目的。这种似乎匪夷所思主张的...
|

|
仿制药和生物类似药行业未来应如何在基因治疗领域发挥...
2021.05.29
个体化药物的目标是为单个患者提供量身定制的治疗药物,因此可能并不能直接适应大批量低价的仿制药行业模式。但美国仿制药和生物类似药行业组织 — 普享药协会(AAM)主席兼首席执行官 Dan Leonard 希望仿制药行业考虑这方面的选择。
Leonard 在 5 月 27 日普享药协会年会的...
|
|
临床试验结果公开:三年没公开,收到罚款通知后两天完...
2021.05.28
美国马萨诸塞州的制药商 Acceleron Pharma 在因未能向 ClinicalTrials.gov 报告临床试验结果而面临美国 FDA 首次民事罚款威胁后的第二天,通过发布摘要结果来履行了其法定义务。
尽管 Accelereon 早在数年前就已在其它地方发表了关于 Dalantercept 和 Axitinib(阿昔替尼...
|

|
美国司法部介入调查礼来新冠抗体工厂质量控制和文件造...
2021.05.28
礼来公司位于新泽西州 Branchburg 生产新冠治疗性抗体的工厂因质量控制问题和涉嫌篡改文件而备受关注。现在美国司法部(DOJ)已介入调查。
礼来于 5 月 27 日公布提交给美国证券交易委员会的 8-K 披露表显示,美国司法部已向礼来发出传票,要求提供与 Branchburg 工厂有关的...
|
|
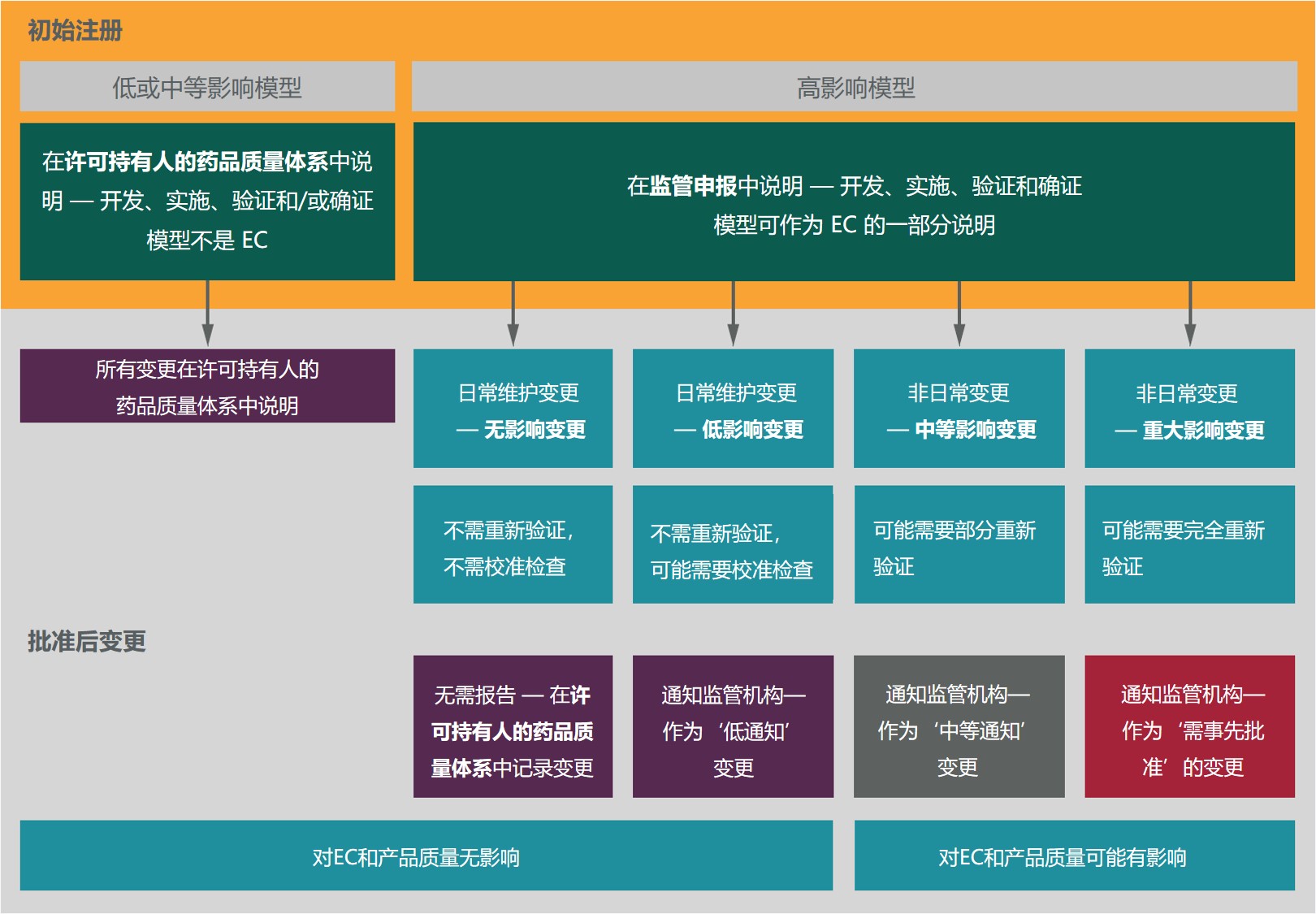
行业组织建议 ICH 降低对制造模型的监管监督,以期...
2021.05.27
最近几个行业组织共同制定了一项提案,用于管理对制药生产过程中使用的模型的监管监督,提出即使对于那些对药品生产有重大影响的模型也可以放松监管使用次要变更途径。
这几个行业组织分别是:BioPhorum、国际药物开发创新和质量联盟(IQ 联盟)以及制药过程分析圆桌会议(PPAR)。他...
|
|
FDA 可能拒审新提交的新冠疫苗紧急使用授权申请
2021.05.27
美国 FDA 于 5 月 25 日更新了《预防 COVID-19 的疫苗紧急使用授权》指南,表示可能会拒绝尚未与 FDA 会面讨论其疫苗的开发者提出的紧急使用授权(EUA)申请。
FDA 在更新指南中表示,“在当前大流行的剩余时间内,除开发者已经与 FDA 就指南中所述的制造过程和临床试验...
|
|
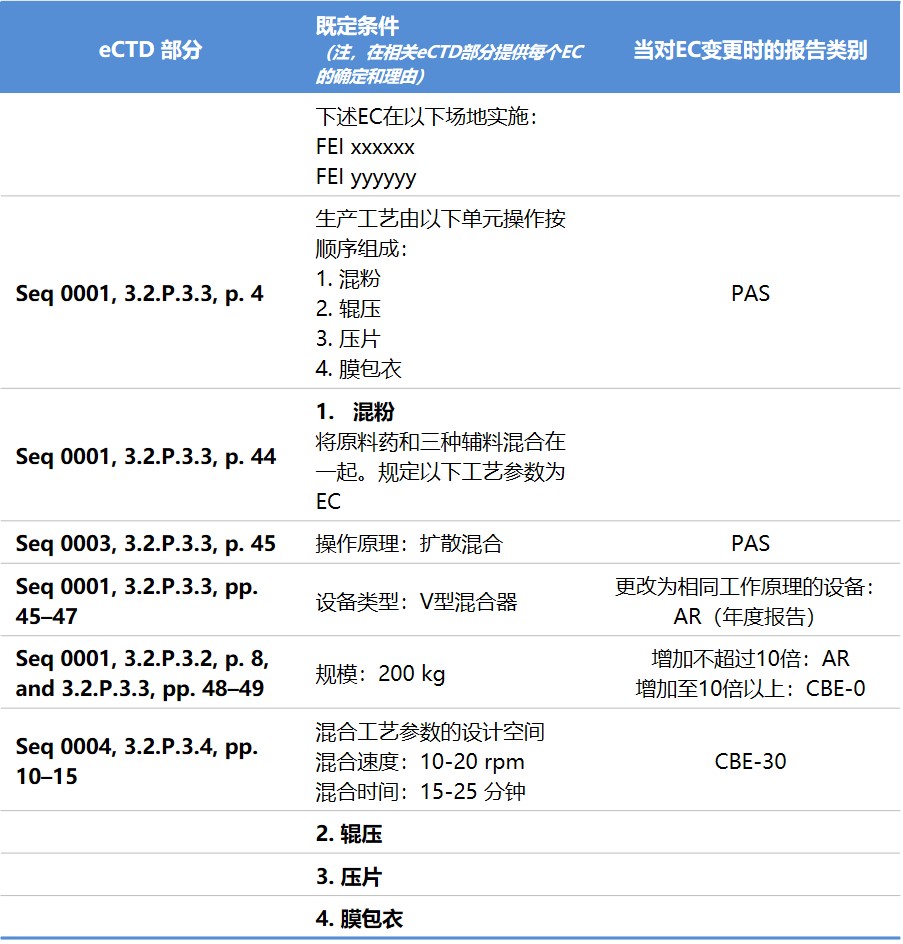
FDA 发布 ICH Q12 实施考量指南,详述如何实施既...
2021.05.26
美国 FDA 于 5 月 20 日发布《ICH Q12:FDA 监管产品的实施考量》指南草案,向制药商解释了如何在各类申请,包括新药申请(NDA)、生物制品许可申请(BLA)以及简化新药申请(ANDA)中提交既定条件(Established Conditions, EC),以及对 EC 的变更报告类别如何确定,以帮助制药商...
|

|
FDA 生物制品主任谈先进制造、卫生高级研究计划局以...
2021.05.26
美国 FDA 生物制品审评与研究中心(CBER)主任 Peter Marks 表示,在下一次大流行爆发之前实施先进制造可以加速用于新兴传染病的疫苗的生产,并可广泛地造福再生医学领域。
Marks 在最近食品药品法律研究所(FDLI)的年会上表示,从国家安全,从全球健康安全角度,我们需要更多地...
|
|
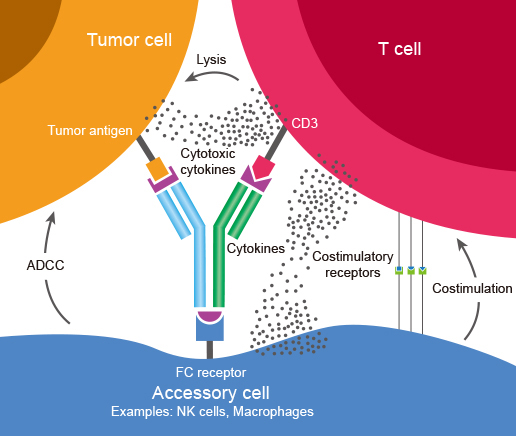
FDA 发布双特异性抗体研发定稿指南
2021.05.25
美国 FDA 于 5 月 24 日发布《双特异性抗体研发项目》定稿指南,为工业界和参与开发双特异性抗体的各方提供了建议,包括对双特异性抗体的一般监管和科学考量,指南解决了在开发双特异性抗体过程中可能出现的挑战,并就支持批准所需的数据类型提供了建议。
双特异性抗体是基因工程...
|