
|
欧洲药品质量管理局任命 14 年来首位新主任
2021.06.30
Petra Dörr 博士将接替自 2007 年以来一直担任欧洲药品质量管理局(EDQM)最高职位的 Susanne Keitel,成为 EDQM 的新主任。
Dörr 目前是世界卫生组织(WHO)药品和卫生产品可及性部门监管和预认证部监管和安全性团队负责人。她将于 2021 年 10 月出任 EDQM 主任。所...
|
|
FDA 公布阿尔茨海默药统计、医学和临床药理学详细审...
2021.06.30
美国 FDA 于 6 月 28 日再次新发布了关于渤健(Biogen)备受争议的阿尔茨海默新药 Aduhelm(aducanumab)的三份审评文件,包括临床药理学(147 页 )审评,共计超过 650 页的资料。
这是继上周 FDA 发布三份审评备忘录之后,FDA 进一步公布的关于 Aduhelm 的详细审评资...
|

|
线上讲座:《生物安全法》解读以及人类遗传资源监管新...
2021.06.29
1.《生物安全法》的出台对研发和临床试验活动有何影响?生物安全法对药品研发注册有什么影响?包括外企计划引入中国的在研新产品。
2.外资企业能否在中国开展细胞基因治疗?外资国内开展基因治疗的限制有哪些?
3. 新生效的生物安全法对于外资主体的具体界定是什么?如内资公...
|
|
ICH 公布以患者为中心的药物开发思考性文件意见征询...
2021.06.28
ICH 以患者为中心的药物开发(PFDD)思考性文件于 2020 年 11 月获得 ICH 大会批准【ICH 将着手制定以患者为中心的药物开发指南 2020/12/12】,确定了纳入患者观点可提高药物开发的质量、相关性、安全性和有效性,并为监管决策提供信息的关键领域。思考性文件还提出了制定新 IC...
|

|
【一周回顾】2021.06.21-06.27
2021.06.28
药审中心发布已上市生物制品药品学变更研究指南,总局发布 2020 年度药品审评报告。ICH 更新以患者为中心的药品研发(PFDD)思考性文件。FDA 定稿生物制品 CMC 变更指南。FDA 发布 IND 和生物利用度/生物等效性研究的安全报告要求及安全评估指南。
上周热点资讯:
FDA 发布...
|
|
【周末杂谈】标签与监管 – 小心你想要的
2021.06.27
加速批准的药品标签中写的和没写的话,都重要
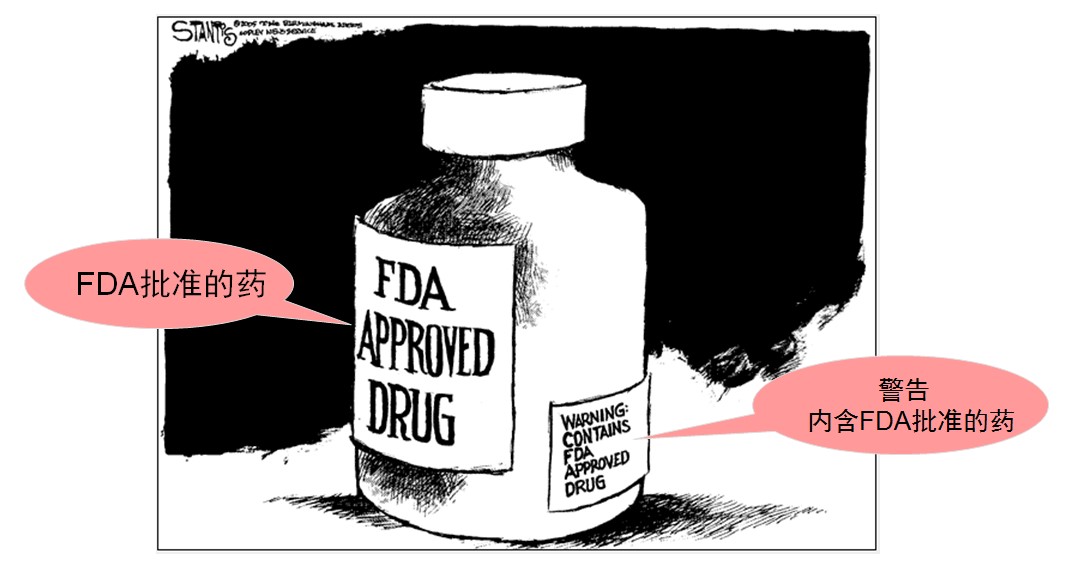
一位朋友曾对我说,FDA的监管用一句话说,就是监管标签的。
标签上写什么,不写什么,都很重要。例如,所有的膳食补充剂,或称健康食品、功能食品、……、都必须在标签上写明“此产品未经FDA审评,不能用来诊断、治疗或预防疾病”,如下...
|
|
葛兰素史克在疫苗生产和开发中试点“数字孪生”
2021.06.26
当汽车工程师设计新车时,他们通常会在上路之前让新车原型通过计算机化的数字模型和测试。在过去一年中,制药巨头葛兰素史克(GSK)公司也将同样的技术应用于疫苗生产。这种方法被称为数字孪生(digital twin),或现实世界对象或过程的计算机化副本。借助实时数字副本,专家们可以获得...
|
|
渤健阿尔茨海默药在欧洲上市的可能性及潜在障碍
2021.06.25
美国 FDA 于 6 月 7 日批准了渤健的颇具争议的阿尔茨海默病药物 Aduhelm(aducanumab)。Aduhelm 被认为是二十年来 FDA 批准的首个针对阿尔茨海默病根本原因的新药。该药通过 FDA 的加速审批路径获得批准,旨在减少大脑中淀粉样蛋白斑块的积聚,以期减少认知能力下降。FDA 对 Ad...
|

|
阿尔茨海默药导致批准门槛降低?FDA 代理局长:我已...
2021.06.25
美国 FDA 加速批准渤健(Biogen)阿尔茨海默病新药 Aduhelm(aducanumab)所引发的余震仍是最近大家关注的焦点。本周二(6 月 22 日)处于舆论漩涡之中的 FDA 最高层领导,代理局长 Janet Woodcock 在美国-印度商会生物制药峰会上发表讲话时评论了对该药的批准。
最近由于 Aduhe...
|
|
FDA 新公布三份审评备忘揭示阿尔茨海默新药内部审议...
2021.06.24
美国 FDA 于北京时间 6 月 23 日早晨发布了三份到目前为止最为详细的有关渤健(Biogen)备受争议的阿尔茨海默新药 Aduhelm(aducanumab)的审评备忘录,包括神经科学办公室解释批准决定的摘要备忘录(69 页 )各自的支持性审评备忘录。
总共 83 页 的三份文件揭示了截至 6 月 ...
|
|
FDA 阿尔茨海默药 Aduhelm 风险获益综合评价重点内...
2021.06.24
美国 FDA 于北京时间 6 月 23 日早在其网站上公布了三份详细的阿尔茨海默新药 Aduhelm(aducanumab)的审评备忘录,其中神经科学办公室解释批准决定的 69 页的摘要备忘录详述了 FDA 对于争议最大的几点问题的讨论和结论,包括:提前终止且不一致的两个三期研究;淀粉样斑块蛋...
|

|
FDA 发布生物制品 CMC 批准后变更定稿指南
2021.06.23
美国 FDA 于 6 月 21 日发布了《已获批生物制品申请的 CMC 变更》定稿指南,帮助生物制品制造商确定其产品哪些类型的变更应在年报中提交,哪些需要提交需事先批准的补充申请(PAS)。
该指南的草案版本于 2017 年 12 月发布,定稿指南对草案做了一些细微的更改。指南涵盖的...
|

|
FDA 可能要求进行上市后研究以分析乳腺癌药物的长期...
2021.06.23
美国 FDA 在 6 月 17 日发布的定稿指南中表示“可能要求”或寻求申办人的同意,进行上市后研究,以分析乳腺癌药物对绝经前和绝经后女性的长期影响。
指南题为《患有乳腺癌的绝经前女性:治疗药研发》,草案于去年 10 月份发布。该指南还为计划将绝经前女性纳入乳腺癌治疗药临床...
|

|
定价分析机构如何评价高价基因和细胞治疗产品的成本效...
2021.06.22
从表面上看,新药的价格越高,其开发者似乎就越难获得药品价格监督机构 — 临床与经济评价研究所(ICER)的认可。对于快速发展的基因和细胞治疗领域的公司而言,这将使 ICER 的审查成为一个难以克服的障碍,尤其是如果该机构的意见在未来确定保险覆盖范围的决定中具有更大权重的话。
...
|

|
PICS 将纳入欧盟 GMP 附录 16 质量受权人认证和...
2021.06.22
6 月 15 日,国际药品认证合作组织(PIC/S)宣布了其将欧盟 GMP 附录16 关于药品质量受权人(QP)认证和批次放行的内容纳入 PIC/S 指南的计划。目的是让非欧盟/欧洲经济区(EEA)成员将附录 16 纳入其监管体系。
欧盟附录 16 涵盖了 QP 的认证,QP 可以为在欧盟的上...
|

|
【一周回顾】2021.06.14-06.20
2021.06.21
国家局发布已上市生物制品变更事项及申报资料要求。欧盟 EMA 发布 2020 年年报;更新上市许可变更法规;发布临床研究中的计算机化系统和电子数据指南草案。美国 FDA 启动肿瘤学真实世界证据计划。识林新增多篇文献和案例研究。
上周热点资讯:
公益组织敦促对阿尔茨海默批准问责...
|

|
阿尔茨海默新药批准影响持续升温,参议员要求 FDA ...
2021.06.21
美国 FDA 加速批准渤健(Biogen)阿尔茨海默病新药 Aduhelm(aducanumab)带来的影响仍在发酵,一位关键民主党议员在 6 月 18 日给拜登总统的信中呼吁罢免 FDA 最高决策者。
西弗吉尼亚州民主党参议员 Joe Manchin 要求拜登总统罢免 FDA 代理局长 Janet Woodcock,并迅...
|

|
【周末杂谈】树与森林,药企与药业
2021.06.20
满足患者需求和助力科技发展的药品监管
从前一日同家人和朋友去原始森林中走路,学了一些关于树生长的知识,触发了一点感想。
森林中有很多杉树,20-30米高,长得茁壮、笔挺向上。偶遇一棵不知何故被连根拔起的树。有意思的是其树根纵深也就1米多(如下图所示)。我问朋友为何?朋...
|
|
阿尔茨海默药批准后续:倡导者不满 FDA 审批肌萎缩...
2021.06.19
美国 FDA 加速批准渤健(Biogen)阿尔茨海默病新药 Aduhelm 引发的争议已波及到该疾病领域之外,肌萎缩侧索硬化症(ALS)倡导者对 FDA 在 ALS 领域的缓慢行动感到不满。
FDA 在加速审批路径下批准了 Aduhelm,加速审批允许根据替代终点批准药物。在 Aduhelm 之前,这一路径...
|

|
公益组织敦促对阿尔茨海默批准问责,要求FDA代理局长...
2021.06.18
在美国 FDA 加速批准备受争议的渤健(Biogen)阿尔茨海默新药之后,消费者倡导组织 — 公共公民(Public Citizen)于 6 月 16 日致信美国卫生部(HHS)部长 Xavier Becerra,呼吁其立即要求对 Aduhelm 的决定负有最大责任的 FDA 的三名高级官员辞职或撤职,包括 FDA 代理局长 Jan...
|