
|
FDA数据可靠性指南草案行业评议概览
2016.08.10
FDA数据可靠性(data integrity,DI)指南草案收集到的评议的数量和深度,以及最近公共论坛上关于指南草案的交流,表明了监管机构在监督和寻求推进行业DI实践方面所面临挑战的规模和复杂性。评议集中于行业关注FDA在指南中传达的监管预期尽可能是清晰的、可行的、基于风险的和全球一致的...
|

|
FDA延长OTC专论审评使用者付费评议期
2016.08.09
8月8日美国FDA在联邦公报(FR)通告上宣布重开OTC专论使用者付费问题的评议期,评议期延长至2016年10月6日。此外,通告指出,FDA“将于2016年10月6日为利益攸关方举行网络研讨会。这次会议是6月10日公开会议的后续,向利益攸关方提供自7月份开始以来的FDA和业界讨论进程状态更新。”
“F...
|

|
四国监管机构检查发现问题,辉瑞暂时关闭其印度工厂
2016.08.09
辉瑞成为最新加入到在印度不断扩大的发现CGMP违规的制药商清单中的一员。6月最后一周,一支由世界四大监管机构检查员组成的引人注目的团队在辉瑞位于印度Chennai附近的工厂发现大量缺陷。辉瑞已暂时停止该工厂的生产,该工厂是一年前辉瑞以170亿美元收购的Hospira单元的一部分。四大监管机...
|

|
业界就生物类似药标签是否应包括可互换性声明产生分歧
2016.08.07
工业界对美国FDA生物类似药标签指南草案的评议显示了关于是否在新产品标签上包含生物类似药可互换性状态声明方面的分歧。而FDA还未发布关于可互换性的指南,并且FDA未认可任何生物类似药与其参照产品具有可互换性。虽然缺少FDA关于可互换性的指南,并且生物类似药已经应用较长时间并且得到...
|

|
2016年FDA仿制药计划行动报告更新
2016.08.06
根据2016财年除批准、暂时批准和原始ANDA接收之外的指标9个月的更新数据显示,仿制药办公室(OGD)大多数指标数据呈现更高趋势。
Activities Report of the Generic Drug Program (FY 2016)
一些指标仅在过去两年中有报道(GDUFA目标的第一年和第二年)。这是因为这份仿制药报...
|
|
印度进一步放松临床试验实施要求
2016.08.05
印度中央药品标准控制组织(CDSCO)于8月2日宣布放宽两项临床试验要求,使得在印度开展临床试验变得更加容易。
CDSCO、卫生服务总局以及卫生和家庭福利部发布,印度药品管理总长G.N.Singh签署的两份联合通告显示,印度将不再阻止临床研究者同时开展三个以上试验,另外,印度将修订其...
|

|
美国主打药品根据患者治疗结果付费
2016.08.04
在信诺保险和安泰保险与制药公司达成基于价值的支付交易之后,另一家主要的医疗保险公司正在积极寻求与制药商就基于患者的治疗效果达成交易。6月下旬,美国新英格兰地区的第二大健康保险公司―哈佛朝圣者医疗保险公司(Harvard Pilgrim Health Care),就调整这两家公司的两个最为重要...
|

|
美国最新研究表明部分生物类似药与原研产品具有可互换...
2016.08.03
8月2日发表在美国医师协会(ACP)《内科学年鉴》(Annal of Internal Medicine)上的一项新研究表明1 ,用于治疗类风湿性关节炎、银屑病和炎症性肠病等疾病的一批生物类似药与相应的更加昂贵的品牌生物制品的安全性和有效性相当。
这篇分析给因高价药品变得越来越不堪重负的美国医...
|
|
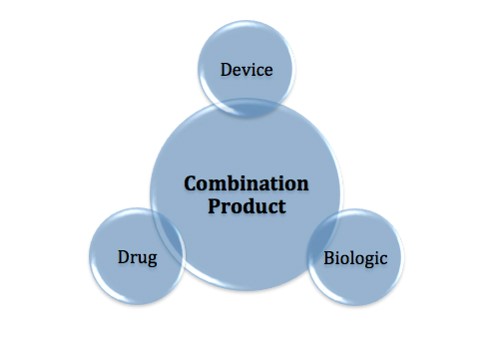
FDA对组合产品开展跨中心试点项目
2016.08.02
美国FDA于8月1日宣布针对药品、器械和/或生物制品的组合产品的跨中心咨询请求(ICCR)过程开展一项新的试点项目。
组合产品在很大程度上对于政策和审评提出了挑战,因为组合产品包括的组成部分属于不同的监管类别(例如,药品和器械,药品和生物制品),由不同的FDA产品中心管辖。因此...
|

|
FDA优先审评券跟踪,价格显露下降趋势
2016.08.01
美国FDA优先审评券(PRV)计划是指申请符合热带疾病产品或罕见儿科疾病产品资格的申办人在申请获得批准后,可获得相应优先审评券,该审评券可向FDA兑现用于未来其它单一产品申请的优先审评,审评券持有人也可以将审评券出售或转让给其它公司。
近日,Gilead公司低调披露已购买第二张FDA...
|

|
GDUFA II期收费模式将改为“分层”收费?
2016.07.31
GDUFA II期谈判双方正在考虑一些新方法来构建仿制药使用者付费,重新授权谈判可能还需要持续数周。由美国FDA提出的一个模式可能会将现有系统改变为在某些情况下设定不同的收费水平的分层收费结构。GUDFA重新授权收费模式小组6月30日的会议纪要表示,FDA和工业界就收费标准“讨论了可能的...
|

|
EMA更新组织架构建立更加精简高效的体系
2016.07.30
7月29日欧洲药品管理局(EMA)公布了对其组织管理架构一些机构调整和重要的战略修订,从而获得更精简、更高效的体系结构并提高行政管理支持。在2013/2014重组机构的基础上,这些变化微调了重新设计的组织模式,以进一步提供EMA运行效率和有效性。所有的变化将于2016年9月1日生效。
EMA...
|

|
FDA拒绝关于生物类似药标签的三份请愿
2016.07.29
7月13日美国FDA拒绝了三份关于生物类似药标签问题的请愿(请愿拒绝函。根据FDA表示,“FDA既没有采纳也没有放弃关于生物类似药标签的任何政策。”此外,FDA指出,最先获批的两个生物类似药标签并不预示着FDA关于生物类似药标签的政策。相反,它们仅反映FDA对这些具体产品的行为。
来自Abb...
|

|
2017财年PDUFA和BsUFA收费标准出现重大折扣
2016.07.28
7月28日美国FDA在联邦公报(FR)通告上分别公布了2017财年(2016年10月1日生效至2017年9月30日到期)处方药使用者付费(PDUFA)和生物类似药使用者付费(BsUFA)收费标准,使用者付费将大幅下降,需要临床数据的新药申请(NDA)费相比2016财年下降超过14%,这是本轮PDUFA五年来首次申请费...
|

|
2017财年GDUFA收费标准公布
2016.07.27
7月26日FDA在联邦公报(FR)通告上公布了2017财年(2016年10月1日生效至2017年9月30日到期)GDUFA收费标准(https//www.federalregister.gov/articles/2016/07/27/2016-17801/generic-drug-user-fee-abbreviated-new-drug-application-prior-approval-supplement-drug-ma...
|

|
FDA公布PDUFA VI绩效目标承诺函
2016.07.26
FDA公布PDUFA VI绩效目标承诺函:2018-2022财年绩效与流程目标
正值处方药生产商付费法案(PDUFA)6个回合的首轮谈判结束一年之计,美国食品和药物管理局(FDA)于今年7月初公布了2018到2022财年的绩效与流程目标的全部细节。(文件内容详见PDUFA重新授权2018到2022财年的绩效与流程...
|

|
美国生物类似药商业上市通知条款新解释
2016.07.25
【编者按】生物类似药商业上市通知条款,即“申请人应在根据351(k)获得许可的生物制品首次商业上市之前不少于180天向参照产品持有人提供通知”,其目的是给品牌药公司留出时间决定提起什么样的专利挑战(如果有的话)。一直以来争论不绝,争论的焦点在于通知时间从何时起开始计算。生...
|

|
【更新提示】药政信息摘要2016.07
2016.07.25
CFDA发布临床试验的电子数据采集技术指导原则(07.29)
CFDA发布药物临床试验数据管理与统计分析的计划和报告指导原则(07.29)
CFDA发布临床试验数据管理工作技术指南(07.29)
总局办公厅关于发布承担首批仿制药质量和疗效一致性评价品种复核检验机构名单的通知(0...
|

|
EMA计划修订临床I期试验指南
2016.07.24
在1月份法国临床试验导致1人死亡5人入院后,欧洲药品管理局(EMA)于7月21日宣布更新其关于首次人体(FIH)临床试验指南的计划pdf
EMA发布草案概念文件Concept paper在2016年9月30日之前向公众征询意见。概念文件列出了对指南的拟议更改,由欧盟范围内的专家小组编写,包括来自许可在...
|

|
FDA支持在检查过程中分享对于检查员的反馈
2016.07.23
企业每次接受检查都有机会与了解企业合规状态前沿的检查员建立良好的工作关系。如果与检查员出现问题你会怎么办?在第120届食品和药品官员协会(AFDO)年度教育会议上,FDA监管事务办公室(ORA)高级官员被问到了这一问题。业界成员提出针对检查员行为的担忧。首要主题是对于报告检查员在...
|