
|
国际药用气雾剂联盟点评 FDA 最新指南
2018.10.08
2018年9月13日-14日,由美国药学科学家协会中国讨论组(America Associate of Pharmaceutical Scientists China Discussion Group,AAPS CDG)和国际药用气雾剂联盟(International Pharmaceutical Aerosol Consortium on Regulation & Science, IPAC-RS)主办的“AAPS CD...
|

|
【更新提示】识林一周回顾(20180930-1006)
2018.10.07
【EMA】上市许可前指南更新(10.03)
新增问答5.1.13,对“如何更改正在进行中的上市许可申请?”作出了回答。
【中译】FDA定稿指南 ANDA递交-内容和格式(10.03)原文 花脸稿
该指南旨在帮助申请人根据“联邦食品、药品和化妆品法案”(FD&C法案)第505(j)条(21 U.S.C...
|

|
全球最权威医学杂志思考何去何从
2018.10.06
《新英格兰医学杂志》(NEJM)集团于上周四宣布,NEJM 总编 Jeffrey M. Drazen 博士将在明年退休。为了确保顺利过渡,Drazen 博士将继续领导期刊和 NEJM 集团,直到任命继任者为止。这一宣布,为世界上最负盛名的医学期刊带来新视角,创造了机会。
Drazen博士于 2000 年出任 N...
|

|
关键性临床试验成本可能并没有想象的那么高
2018.10.05
一项新研究表明,获得监管批准所需的关键性临床试验的中位数成本仅为 1900 万美元。换而言之,用于说服 FDA 批准新药的关键科学证据只占整体研发成本的一小部分,
根据发表在 JAMA Internal Medicine 上的研究1 显示,此类试验的最低成本从用于罕见代谢紊乱药物的四名患者试验的...
|

|
美墨加贸易协定为生物制品设定十年专营权
2018.10.04
新的美国-墨西哥-加拿大贸易协定规定,生物制品在产品“首次上市批准之日起至少 10 年内”拥有市场保护。
《美国生物制品价格竞争和创新法案》(BPCIA)规定,生物类似药申请必须在参照产品首次获得许可之日起 12 年之后才能获得批准。贸易协定不会改变这一规定,但会让将保护期缩...
|

|
FDA 发布公民请愿指南阻止品牌药商故意拖延仿制药批...
2018.10.03
美国 FDA 于 10 月 2 日发布《根据联邦食品、药品和化妆品法案第 505(q)节规定的公民请愿和停止诉讼请愿》修订指南草案,旨在为 505(q) 请愿提供更高效的路径,并使 FDA 能够将更多审评员资源集中在科学审评上。
这是 FDA 药品竞争行动计划(DCAP)增加处方药市场竞争...
|

|
复杂仿制药历史是由参与者书就的
2018.10.02
9 月 5 至 7 日,GRx+Biosims 会议在美国马里兰州巴尔的摩举行,会议的最后一天是 FDA 主持的关于复杂产品 GDUFA II 期 ANDA 前计划的内容。
仿制药办公室(OGD)研究与标准办公室监管事务副主任 Kris Andre 详细讨论了与复杂仿制药会议相关的组织工作和 FDA 的期望。...
|

|
【更新提示】识林一周回顾(20180923-0929)
2018.10.01
【CDE】关于进一步做好289基药品种一致性评价申报与技术审评相关工作的通知(09.29)
一、对于已经基本完成一致性评价技术研究工作正在整理形成申报资料的品种,药品企业如存在不清楚、不明确申报资料整理的相关技术问题,可通过药品审评中心申请人之窗向药品审评中心项目管理人提出沟通...
|

|
专题课 - 国际药品危机事件管理的法律、商务和技术...
2018.09.30
IPEM-识林 专题课 (首轮通知)
国际药品危机事件管理的法律、商务和技术考虑
北京大学中关新园1号楼科报厅 2018年11月9-10日
今年夏天,我国一家出口药企因原料药杂质问题而引发全球产品召回的危机。本周,美国和欧盟全面禁止其产品进口,形成了一个复杂的监管合规...
|

|
药品国际危机事件的防范与应对
2018.09.29
2018年9月2日,第13期识林研习会在北京大学中关新园如期举办,三位资深专家 — James Johnson博士,Garth Boehm博士和尹放东博士,与30余位药企高管和药监人员,从法律、商务和技术角度共议中国药企进入全球市场可能面临危机的预防、应对和控制。【国际危机事件管理的法律、商务和技术考...
|

|
美国欧盟大面积禁止进口华海产品
2018.09.29
继美国 FDA 于 9 月 20 日发布针对浙江华海药业的检查 483 之后,FDA 与欧洲药品管理局(EMA)于 9 月 28 日分别发布广泛的进口禁令和不合规报告,采取扩大范围的禁止进口、取缔上市许可等严厉措施。而这一系列行动之后可能的监管和商业后果有哪些?对行业更深远的影响又是什...
|

|
FDA 今年签发更多完全回应函
2018.09.27
2018 财年美国 FDA 对简化新药申请(ANDA)签发了远超过以往任何年份的完全回应函(CRL)。2018 财年到目前为止签发 2515 封 CRL,2017 财年为 1603 封,2016 财年为 1725 封。RAPS 的撰稿人 Zachary Brennan 表示,这可能是由于申请数量激增或其它原因造成的。
但前...
|
|
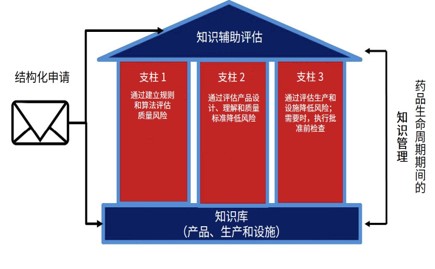
FDA 知识辅助评估和结构化申请计划提上议程
2018.09.26
美国 FDA 于 9 月 20 日召开药品科学和临床药理学咨询委员会会议,讨论 FDA 知识辅助评估和结构化申请(KASA)的实施计划。
如 FDA 局长 Scott Gottlieb 在六月份博客中说的那样,KASA 平台旨在将仿制药审评从基于文本的评估现代化为基于数据的评估。但周四的讨论清楚的表明...
|

|
FDA 发布两份指南为药品申请的高质量递交提供建议
2018.09.25
美国 FDA 于 9 月 24 日发布了《ANDA 递交 — 内容和格式》定稿指南。这份长达 32 页的指南比 2014 年的指南草案更详细,提供了对文件某些部分和要求的扩展说明。同时还发布了《NDA 和 BLA 良好审评管理原则和实践》指南草案,向工业界和审评工作人员介绍了在新药审评中审...
|

|
FDA 将对未能公开临床试验数据的企业罚款
2018.09.24
作为生物研究合规监测的一部分,美国 FDA 准备对那些未能向 ClinicalTrials.gov 网站提交临床试验数据的企业罚款。
9 月 20 日发布的新指南草案Civil Money Penalties Relating to the ClinicalTrials.gov Data Bank概述了 FDA 强制执行在 ClinicalTrials.gov 网...
|

|
【更新提示】识林一周回顾(20180916-0922)
2018.09.23
【WHO】制剂预认证变更:常见问题与解答(09.22)
本指南回答了与预认证变更申请的8个具体问题,例如实施和审评时间表问题,是否需要提交变更和实施日期的年度通知(annual notification),是否需要为每个变更单独提交申请,是否可以将一个在已批准生产场地生产的某个批量的产品在另外...
|

|
FDA 药品申请实时审评成为现实
2018.09.21
美国 FDA 已经开始使用药品申请的实时审评,一得到试验结果就立即评估临床数据。这意味着 FDA 可以在申请人提交上市申请后立即批准新的适应症。目前,该方法仅在 FDA 肿瘤卓越中心(OCE)通过两个针对已获批抗癌药的补充适应症的试点项目实施。但之后可能会扩展到新药和新生物制剂。...
|
|
2015年中国药典和与美国药典中的微生物检测方法比较
2018.09.20
一、中国药典2015年版和与美国药典相关章节
表1 中国药典2015年版第四卷相关章节
检验方法
指导原则
1101 无菌检查法
1105 非无菌产品微生物限度检查:微生物计数法
1106 非无菌产品微生物限度检查:控制菌检查法
1107 非无菌药品微生物限度标准
1...
|
|
药业高管将大幅抬高药价视为“道德要求”
2018.09.19
一名药业高管为他做出的将一种抗生素混合物的价格提高到每瓶两千多美元的决定辩护,认为“以最高价格销售产品是一种道德要求”。
根据 Elsevier 的 Gold Standard 药品数据库,上个月,位于美国密苏里州的一家小型制药公司 Nostrum Laboratories 一瓶呋喃妥因的价格从 474.75 美...
|

|
缬沙坦杂质癌症风险高还是低,立场不同态度自然不同
2018.09.18
【编者按】世上的事本不是轻易就能辨清对错,尤其是在涉及多方利益时。科学家们小心求证、复杂推演,律师们慷慨激昂、义愤填膺,你方唱罢我登场。监管者又抛出另一杂质,火上浇油。缬沙坦杂质事件究竟将走向何方,我们继续关注。
概念验证研究
英国医学杂志(BMJ)于 9 月 1...
|