
|
欧盟和美国协调简化新冠治疗药儿科研究申报程序
2020.06.05
随着在儿童人群中发现与新型冠状病毒疾病(COVID-19)相关的多系统炎性综合征,抗冠状病毒药物的儿科研究愈发受到重视,美国和欧盟监管机构联合希望通过提供行政程序方面的帮助,推动对于潜在新冠治疗药的儿科研究。
在 6 月 2 日发布的共同说明中,欧洲药品管理局(EMA)和美国 FD...
|

|
美国参议院质询 FDA 药品生产境外检查
2020.06.05
【编者按】此听证会直接事关出口美国的中国药企。但国会听证,有时形式重于内容。说的话,哪些可按字面理解,哪些还有其它意思,外人有时犯愁。感谢美国Hogan Lovells律所的Jim Johnson和Chris Fanelli律师,他们也是IPEM的教师,梳理了听证会的内容,并与大家分享。
link=13px...
|

|
老问题新热度:FDA 再次因海外检查不力饱受批评
2020.06.04
国外检查提前通知,依赖企业方提供翻译,大流行期间停止国外检查的影响等。
美国 FDA 再次因其在国外药品生产设施检查方面的问题受到国会和美国政府问责办公室(GAO)的诘难。问题都不是新问题,有些问题甚至已经被提了有十年之久,但是在新型冠状疾病(COVID-19)大流行以及国际大...
|

|
FDA 发布 26 篇新 BE 指南和 43 篇修订指南
2020.06.04
美国 FDA 于 6 月 3 日发布了针对 49 种活性成分的 69 篇具体产品生物等效性(BE)指南,以帮助仿制药开发。到目前为止,FDA 共发布了 1903 篇具体产品指南。识林将很快整理发布修订指南的对比花脸稿,以便识林会员对照查看修订变化。
这一批 69 篇具体产品指南包括:26 篇...
|

|
FDA 从 COVID-19 大流行学到了什么
2020.06.03
FDA 将寻求永久性落实那些能够更快地促进审评和许可的措施
危机危机,既是危险所在也是机遇所在。如何勉力渡过危险又能从中找到机会壮大自己,从历史上看 FDA 似乎在这方面都做得很好。此次大流行也不例外,既是对 FDA 监管审评能力的考验,FDA 也从中汲取经验并寻找机会改善惯常...
|

|
FDA 就建立罕见疾病临床试验网络公开征询意见
2020.06.03
美国 FDA 正在就如何建立和维持一系列罕见疾病的全球临床试验网络征求意见。这样的临床试验网络通常是由临床试验组织和医生的集合,可以在许多场地就给定的疾病领域展开协调和支持。该意见征询是 FDA“罕见病治疗加速计划”(Rare Disease Cures Accelerator)的一部分。
FDA 于 ...
|

|
微生物实验室中的数据完整性建议
2020.06.02
制药商应使用流程图来记录如何在微生物实验室中开展工作,并且应具有强有力的质量文化,鼓励员工在看到潜在问题或错误时能够“大声疾呼”。这些都将为解决实验室中的数据完整性问题大有助益。
以上这些建议由葛兰素史克负责全球审计和亚太地区审计工作的 Bruce Loxley 和 Amgen 公...
|

|
USP 放弃在内毒素检测章节增加重组因子C,鲎试剂地位...
2020.06.02
重组因子C试剂将作为独立章节收入USP-NF
美国药典(USP) 5 月 29 日发布https//www.uspnf.com/notices/bacterial-endotoxin-test-gen-announcement-20200529 药典通告表示,将天然鲎试剂的合成替代品 — 重组因子 C(rFC)作为独立章节引入 USP-NF 官方文件,...
|

|
【一周回顾】2020.05.25-05.31
2020.06.01
上周美国 FDA 在疫情期间仍持续关注亚硝胺杂质问题,在某些二甲双胍缓释片中发现 NDMA 超标,杂质根源仍在调查中,IPEM 教师组提出推测;FDA 着手大修已有 40 年历史的《橙皮书》;FDA 发布指南解释疫情可能给药品申请审评和沟通会议带来的影响。EMA 临床药理学和药代动力学问...
|

|
FDA 橙皮书现代化提上议程,四十年来首次大修
2020.06.01
治疗等效性代码或升级, 专利信息涵盖范围扩大
在距《橙皮书》首次创立近 40 年之际,美国 FDA 开始着手对《橙皮书》进行现代化改造,FDA 正在征询包括有关《橙皮书》使用方式和使用人,以及应在书中列出的新专利类型的信息,例如药械组合产品器械部分的专利或者已获批药品风险评...
|

|
【质量对话】药品质量高低,能这么说吗?
2020.05.31
记者:近日一大新闻是FDA通告在糖尿病治疗药物二甲双胍缓控释制剂中发现了超标的致癌物质亚硝胺(N-Nitrosodimethylamine,NDMA)【与原料药无关:FDA 公布二甲双胍缓释片亚硝胺杂质超标】。但在速释制剂中尚未发现此类问题。据上海安必生制药雷继峰总裁介绍,抽检企业中的三家中国生产...
|
|
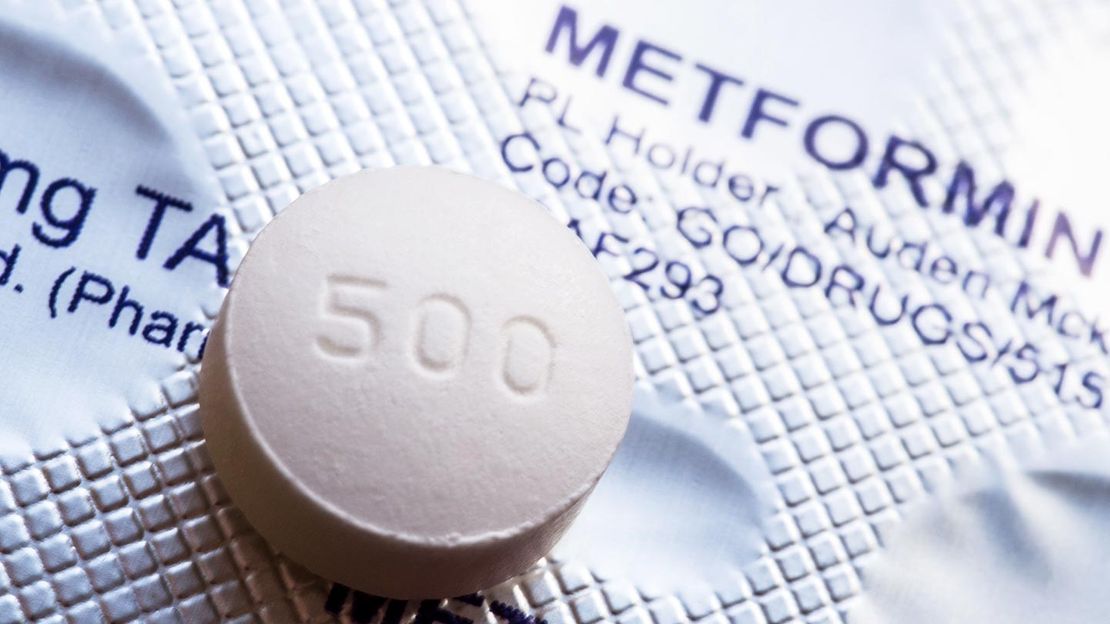
与原料药无关:FDA 公布二甲双胍缓释片亚硝胺杂质超...
2020.05.30
NDMA 问题不断发酵 , 并非同一现象在不同药品的重复,而是反映出行业对该杂质的科学认知不断加深。
美国 FDA 于 5 月 28 日发布通告,表示在糖尿病治疗药物二甲双胍缓释制剂中发现了不可接受水平的致癌物质 N-亚硝基二甲胺(NDMA)。但在速释制剂中尚未发现此类问题。
FD...
|

|
FDA 问答指南解释疫情可能对药品审批和正式会议的影...
2020.05.29
疫情相关急需或短缺仿制药可获优先审评
美国 FDA 于 5 月 27 日发布立即生效指南《COVID-19 公共卫生紧急事件对正式会议和使用者付费申请的影响 — 问题与解答》,解释了新型冠状病毒疾病(COVID-19)突发公共卫生事件如何影响正式会议的执行以及 FDA 对使用者付费相关申请的...
|

|
EMA 提供针对欧盟和非欧盟市场产品的同步审评
2020.05.29
优化监管审评资源, 防止两次申报间的审评差异
欧洲药品管理局(EMA)正在对那些既申请针对整个欧盟市场又申请针对非欧盟国家市场的药品或疫苗提供同步审评的可能性。
EMA 解释指出,欧盟集中上市许可申请(MAA)和根据第 58 条(欧盟外使用药品)申报的同步审评将有助于优化国...
|
|
FDA 药品质量评分系统久不落地,药房开发自己的优质...
2020.05.28
最近一篇论文中,一群学者和药剂师认为,基于监管行动和化学分析的评分系统可以刺激制药商生产更多优质药品并减少短缺,同时改善公共卫生。这篇发表在 medRxiv 的预印版论文1中表示,该想法“对于在美国药品供应链中增加急需的透明度,并使医疗系统购买方和药品支付方避免劣质药至关重要...
|
|
英国允许瑞德西韦以许可外用药的方式治疗新冠
2020.05.28
英国药监局给出了这项许可所基于的科学考量
英国药品与医疗保健产品监管机构(MHRA)于 5 月 26 日在早期获取药物计划(Early Access to Medicines Scheme,EAMS)下允许瑞德西韦用于治疗新型冠状病毒疾病(COVID-19)某些重症住院患者。
EAMS 于 2014 年首次推出,其目...
|

|
美国新一轮药品收费谈判即将拉开序幕,GDUFA 谈判关...
2020.05.27
美国 FDA《处方药使用者付费法案》(PDUFA)重新授权的启动会议已定在 7 月 23 日举行,这将是 PDUFA VII(2023-2027 财年)续签谈判的正式开始。会议将在线举行,FDA 要求参会者需在 6 月 23 日之前https//www.fda.gov/drugs/news-events-human-drugs/public-meeting-reauthoriz...
|

|
WHO 预认证首个利妥昔单抗生物类似药
2020.05.27
世界卫生组织(WHO)于 5 月 25 日https//extranet.who.int/prequal/news/first-rituximab-biotherapeutic-products-prequalified 预认证了首个利妥昔单抗生物类似药,此举可能使这一昂贵的、挽救生命的生物治疗药品更加经济,可惠及全球更多有需要的患者。
利妥昔单抗(ritux...
|

|
英国 MHRA 2018 GMP 检查缺陷趋势分析:数据总览
2020.05.26
英国药品与医疗保健产品监管机构(MHRA)于 2019 年 10 月发布了其在 2018 年的 GMP 检查缺陷,与前几年不同,2018 年 GMP 检查缺陷数据采用了电子表格的形式,公布了 6200 多行数据,人们可以根据自己的需要进行解析和呈现数据。而此前的 2015 年,MHRA 均是提供的约 10...
|

|
药品改配方策略:为制药商和患者提供新机会
2020.05.26
所有改配方都必须使患者受益,并且确保不给患者带来损害。
最近一项研究估计,开发一种新药并推向市场的平均成本为 13 亿美元。【最新研究估算药物开发成本约为 13 亿美元,引发各方争议】这么高的投资以及药物开发面临着各种潜在失败,开发难以操控的新化学实体的复杂性日益增加,...
|