
|
【全文翻译】FDA 药品质量办公室 2020 年度报告
2021.02.15
美国 FDA 药品质量办公室(OPQ)于 2 月 11 日发布 2020 年年度报告,这是自 OPQ 成立以来发布的第四份年报(前三年的年报全文翻译点击相应年份阅览:2019 年;2018 年;2017 年)。今年的年报版式上与过去两年类似,但增加了多媒体链接,一些重要事项直接加入了相关视频链接...
|

|
【周末杂谈】热爱雪道
2021.02.14
当老师成为过时和多余,学生可以进入下一阶段学习时,教育才算成功
今天是大年初三,想必大家都沉浸在喜庆的过年气氛中。《周末杂谈》也凑个热闹,分享一篇关于孩子教育和成长的文章。原文刊载于今年一月的美联航Hemispheres旅游和购物杂志,用意恐怕是介绍美国怀俄明州著名的Jackson Ho...
|

|
FDA 药品质量办公室 2020 年度报告概览
2021.02.13
美国 FDA 药品质量办公室(OPQ)于 2 月 11 日发布 2020 年年度报告,这是自 OPQ 成立以来发布的第四份年报(前三年的年报全文翻译点击相应年份阅览:2019 年;2018 年;2017 年)。今年的年报版式上与过去两年类似,但增加了多媒体链接,一些重要事项直接加入了相关视频链接...
|
|
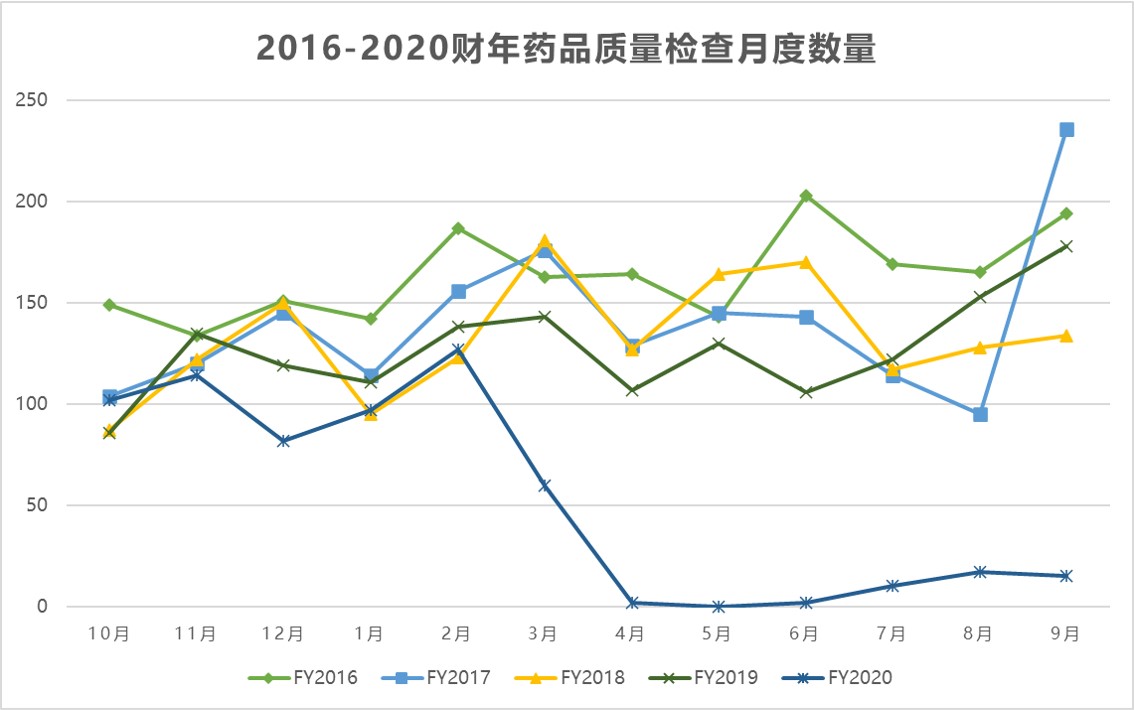
美国 FDA 检查分类情况回顾,做好准备迎接未来的检...
2021.02.12
识林祝大家过年好!牛年第一天我们来回顾一下 FDA 2020 财年的检查分类情况,以及通过这些数据,企业可以提前为未来的检查做哪些准备。
去年,疫情严重影响了美国 FDA 的执法计划,这一影响将在今年持续,并可能波及未来几年。上周识林集中报道了有关 FDA 首封基于远程记录审查的警...
|
|
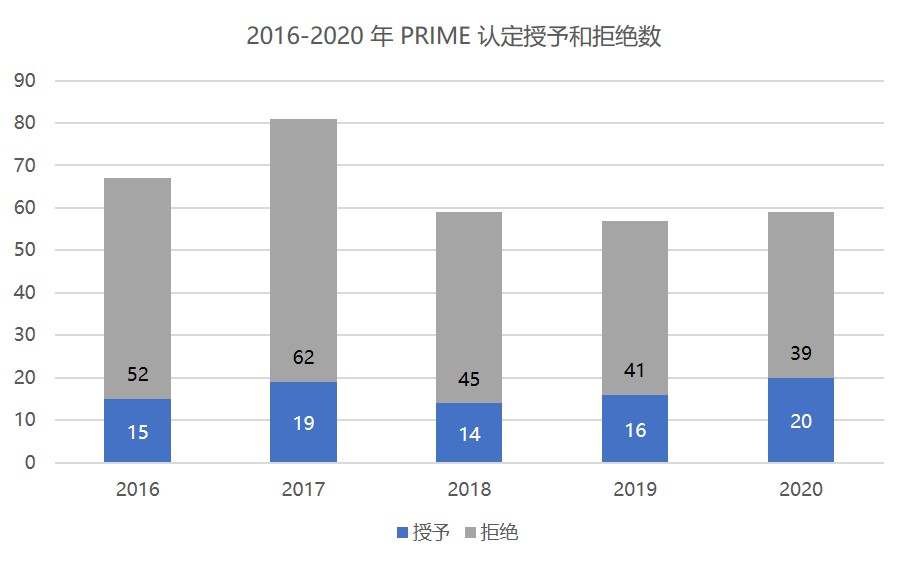
欧盟 2020 年 PRIME 优先药品计划回顾
2021.02.10
欧洲药品管理局(EMA)的优先药品(PRIME)计划是一项旨在加强针对未获满足的医疗需求的药品的开发支持。2020 年,共有 20 个研究性药品获得 PRIME 认定,是该计划自 2016 年启动以来数量最多的一个年份(虽然数量差距较小)其中一些针对新治疗领域和适应症。
PRIME 于 2016 ...
|

|
EMA 提供 PRIME 优先药品计划工具箱指南,加速开发...
2021.02.10
欧洲药品管理局(EMA)正在试图帮助获得 PRIME(优先药品)计划认定的研究性药物开发人员,以最大程度地增大其快速开发产品并赢得上市许可的机会。
EMA 表示,“到目前为止的经验表明,在 PRIME 计划中为产品准备稳健的质量数据包时,开发者经常会遇到困难。”为解决这一问题,EMA...
|
|
Keytruda 乳腺癌新适应症审评简报,数据不足毒性大试...
2021.02.09
近日,美国 FDA 对默沙东(Merck & Co)用于治疗高危早期三阴性乳腺癌患者的 PD-1 免疫疗法 Keytruda(pembrolizumab)补充申请提出了多方面的批评。
根据 FDA 公布的计划于 2 月 9 日召开的肿瘤药专家会的会前简报资料显示,默沙东正在寻求对 Keytruda适应症补充申请...
|

|
FDA 紧急使用授权获得者应准备好应对疫情后的诉讼和...
2021.02.09
在新冠(COVID-19)大流行状态下,制药商从公共卫生紧急情况授予的监管灵活性中受益,使他们能够以更快的速度将 COVID-19 产品推向市场。但是,一旦公共卫生紧急情况结束,并且对其产品的紧急使用授权(EUA)终止,制药商就可能面临政府执法行动和诉讼。
Covington & Burling 律所律师...
|

|
【一周回顾】2021.02.01-02.07
2021.02.08
国家药监局附条件批准科兴的新冠病毒灭活疫苗。药审中心发布治疗性蛋白质药物临床药代动力学研究指南。识林针对 FDA 开发抗逆转录病毒治疗药物指南推出注释性指南,通过实例帮助对指南的理解。FDA 发布 2021 年生物制品指南制定计划,将发布新指南应对新冠病毒变种,并公布扬森新冠...
|

|
世界首套在药品生产线中通过验证的 AI 目检系统
2021.02.08
最近,总部位于德国的工艺和包装技术提供商 Syntegon 宣布在其自动检查机中安装了第一套经过充分验证的、利用人工智能(AI)的目检系统。公司在新闻稿中表示,这套 AI 目检系统的安装是公司持续努力将 AI 引入药物目检的重要一步,这在制药行业中仍然是一个存在很大未知的领域。
A...
|

|
【周末杂谈】监管的春天来了?
2021.02.07
美国忽左忽右的监管政策,但愿不会影响到FDA
1月20日,拜登总统就职当天,签署了17项总统政令。媒体的报道集中在新冠防治、经济救济、环保和移民政策等社会广泛关注的政令上。对药业可能有重要影响的,则是未引起普遍注意的一项名为 “监管审查现代化”(Modernizing Regulatory Revi...
|
|
FDA 将制定新指南并召开疫苗专家会应对新冠病毒变种
2021.02.06
新冠(COVID-19)病毒变种促使新冠疫苗生产商开始开发现有产品的更新。为加快这一开发过程,美国 FDA 表示正在制定有关针对变种病毒的更新疫苗的加快审评规则。
FDA 在决定是否因 SARS-CoV-2 病毒的新变种而要求新冠治疗药或疫苗更新紧急使用授权(EUA)时将考虑多个因素,包括...
|
|
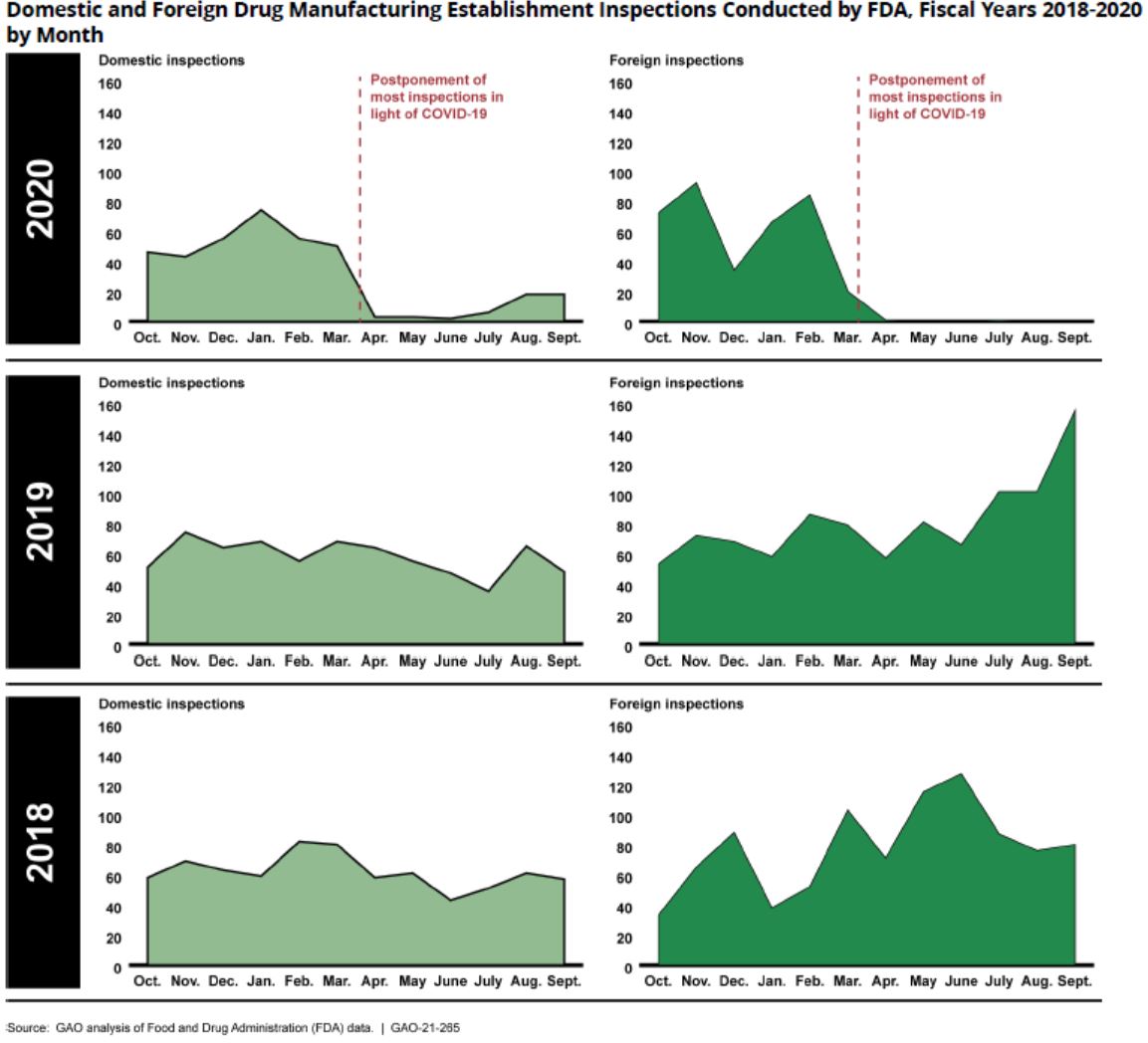
美国政府报告呼吁 FDA 考虑检查替代方法解决积压,...
2021.02.05
美国政府问责办公室(GAO)于 1 月 28 日发布了一份题为《COVID-19:关键疫苗分配,供应链,项目完整性,以及其它需要联邦政府重点关注的挑战》的近 350 页的报告(报告全文和治疗产品、医护用品供应链、卫生保健指标数据收集、药品生产检查、联邦合同、工人安全和健康监督、对渔业...
|

|
英国兴建疫苗制造与创新中心开发新制造工艺
2021.02.05
英国面向未来的疫苗采购吸引了来自英国政府的巨额投资,以及制药行业的资金承诺和学术界的科学专业知识的投入。在英国牛津郡的一个大型中心 — 疫苗制造与创新中心(VMIC)很快将在中央基金的资助下开始运转。
VMIC 的建立是为了促进和加速英国疫苗行业的发展。这是英国第一个专门的...
|

|
FDA 对在中国的检查及远程记录审查的一些说明
2021.02.04
感谢美国 FDA 驻华办助理主任柯雷恩(Lane Christensen)博士的支持,稿件中大部分内容来自 2020 年 10 月 ISPE 年会以及 12 月 CPhI 大会上他的演讲。
昨日我们介绍了【法律专家对 FDA 首封远程记录审查警告信的解析和建议】,今天我们来看看 FDA 对于疫情下的检查...
|

|
FDA 发布 2021 年生物制品相关指南制定计划
2021.02.04
美国 FDA 生物制品审评与研究中心(CBER)发布了其计划于 2021 年新增和修订的指南清单。与上个月 FDA 发布的药品指南制定计划相比【FDA 发布 2021 年药品指南制定计划 2021/01/29】,生物制品指南制定计划显得十分精简,清单仅包括 14 篇指南,比 2020 年指南计划中的 31 ...
|

|
法律专家对 FDA 首封远程记录审查警告信的解析和建...
2021.02.03
2021 年 1 月 22 日,美国 FDA 向宁波余姚市益佳日化公司签发了一封警告信,警告信是 FDA “根据《联邦食品、药品和化妆品法案》(FDCA)第 704(a)(4) 条的规定在 2020 年 3 月 31 日提出了记录和其它信息要求,FDA 审查了益佳日化回复提交的记录”而发出的。这似乎...
|

|
欧盟检查员分享远程 GMP 检查经验,或将成永久性措...
2021.02.03
在正在进行的试点取得早期积极成果之后,欧洲药品质量管理局(EDQM)计划将“实时远程检查”作为其 GMP 检查计划的一项永久性措施。
这项试点是由于与 COVID-19 相关的旅行限制导致的现场检查的推迟而启动的。到目前为止,EDQM 的检查员已经从他们在欧洲的办公桌旁对印度两家制药...
|

|
Recent FDA Warning Letter Highlights Potential R...
2021.02.03
On January 22, 2021, FDA issued a Warning Letter to Yuyao YiJia Daily Chemical Co., Ltd., an over-the-counter drug manufacturer located in Ningbo, China. The Warning Letter was issued based on FDA’s review of “the records Yuyao submitted in resp...
|

|
两项研究揭示雷尼替丁与亚硝胺生成和癌症风险之间的显...
2021.02.02
美国在线药房 Valisure 曾于 2019 年在胃灼热药 Zantac 及其雷尼替丁仿制药中发现异常高含量的致癌性亚硝胺杂质而引发轩然大波。全球十几个国家采取了召回行动。但对于这种常用且一部分产品是作为非处方药出售的胃灼热药引发的恐慌并不止于此,Valisure 进一步指出,雷尼替丁中的亚...
|