|
行业组织要求 FDA 提供更多可互换生物制品指南
2020.12.25
行业团体和生物类似药制造商正在提交反馈意见要求美国 FDA 对可互换生物类似药提供明确指南。这些反馈意见是作为《生物类似药使用者付费法案》重新授权(BsUFA III)的一部分而提出的。对于 BsUFA III 改进的建议,是 FDA 公开征求意见的一部分。FDA 最近还举行了一次公开会议,启动 ...
|

|
WHO 关于利福喷丁和利福平中亚硝胺问题的更新
2020.12.24
WHO 预认证药品小组(PQT/MED)在今年 7 月份首次通告了赛诺菲 Priftin(利福喷丁)中发现亚硝胺杂质的情况。【抗结核药利福喷丁中发现亚硝胺杂质,来源与风险正在调查中 2020/07/11】后美国 FDA 于 8 月份解释了其对两种抗结核药利福平和利福喷丁中亚硝胺杂质超标的处理方式...
|

|
英国和印度或于下周批准阿斯利康新冠疫苗
2020.12.24
印度很可能在下周批准牛津/阿斯利康的新冠(COVID-19)疫苗用于紧急使用,可能成为第一个为阿斯利康疫苗提供监管许可的国家。而英国紧急情况科学顾问小组成员本周三也表示英国政府可能会在圣诞节之后授权阿斯利康疫苗。
据路透社报道,印度作为世界上最大的疫苗生产国,希望在下个月...
|

|
欧洲药典发布亚硝胺通则,更新 CEP 认证的当前状况
2020.12.23
欧洲药典发布了新通则,为评估降血压药和其它药物中的亚硝胺杂质设定了检测方法。欧洲药品质量管理局(EDQM)于 12 月 7 日宣布了新章节,该章与最近的美国药典通则 1469 一致。
欧洲药典(EP)通则2.5.42 针对在 EP 各论涵盖的五种血管紧张素 II 受体拮抗剂(沙坦类,包...
|
|
FDA 发布疫情期间审评时限指南,试图降低申请人期望...
2020.12.23
美国 FDA 于 12 月 21 日发布《COVID-19 公共卫生紧急事件期间申请人对完全回应函的回复需要设施评估时的审评时限》立即生效指南,解释了 FDA 如何为某些需要批准前检查的申请设定审评时间表。
FDA 进行现场检查的能力受到新冠(COVID-19)疫情的严重影响。虽然 FDA 正在...
|

|
欧盟附条件批准辉瑞-BioNTech 新冠疫苗
2020.12.22
欧洲药品管理局(EMA)于 12 月 21 日周一建议欧盟委员会对辉瑞/BioNTech 的新冠(COVID-19)疫苗授予附条件上市许可,几个小时后欧盟委员会对疫苗签发了正式附条件上市许可(CMA)。欧盟范围内的首次疫苗接种预计将在本周末(12 月 27 日)开始。
EMA 对 COVID-19 疫苗...
|

|
印度新冠疫苗试验不良反应引发质疑,辉瑞疫苗需要在印...
2020.12.22
印度药品管理总局(DCGI)可能会要求辉瑞/BioNTech 寻求在印度的加速批准(类似于紧急使用授权)之前进行本地临床试验。
这可能是辉瑞/BioNTech 在全球批准道路上遇到的第一个关卡。在 12 月 9 日 DCGI 的专家委员会上,辉瑞印度公司曾希望有更多时间做介绍。在那之后,辉瑞...
|

|
【一周回顾】2020.12.14-12.20
2020.12.21
药审中心发布经口吸入制剂仿制药生物等效性研究指导原则。识林将于明日上午举行“FDA 生物制品研发、合规监管体系与检查优先级”免费线上讲座。FDA 召开疫苗专家会,发布第二个新冠疫苗紧急使用授权;发布与仿制药研发相关的受控函定稿指南。欧盟含基因重组细胞药品的质量、非临床和临...
|

|
欧盟基因和细胞治疗药物开发指南,含 CAR-T 细胞的...
2020.12.21
欧洲药品管理局(EMA)更新了其针对具有转基因细胞的新药开发的行业指南,其中包括有关嵌合抗原受体 T(CAR-T)细胞治疗药物的特殊临床考虑的附录。新指南指出,“EMA 已经认识到,这是一个不断发展的领域,指南应可以在合适的情况下应用于任何新产品。”
这份 36 页的指南提供了...
|

|
【周末杂谈】法律、律师与 FDA
2020.12.20
识林建议讨论一位读者的问题:为何美国的律所律师对FDA的监管那么熟悉?
本人既非律师,也无律所或FDA任职经验,只作为旁观者和外行,杂谈一下。
FDA存在的唯一理由是落实美国药品法。药品法是联邦法,是对跨州商贸的约束,FDA的一切举动都必须以此法为依据,所制定的规章、指南和政...
|

|
新冠疫苗领跑者已撞线,后来者面临更多试验执行困难
2020.12.19
随着几款新冠(COVID-19)疫苗陆续在多个国家获得紧急使用授权或暂时使用,目前仍然在试验中的疫苗可能面临这更多问题,包括揭盲策略、参与者脱落、两种不同疫苗之间的相互作用等等。
在 FDA 上周批准首个 COVID-19 疫苗之时,阿斯利康向在美执行临床试验的研究者发出了文件,说...
|
|
FDA 关于 Moderna 新冠疫苗紧急使用授权的专家会资...
2020.12.18
美国 FDA 于 12 月 17 日召开疫苗与相关生物制品专家委员会(Advisory Committee)会议讨论 Moderna 的新冠(COVID-19)疫苗 mRNA-1273 的有效性和安全性是否足以支持紧急使用授权(EUA)。会议表决结果为:20 赞成,0 反对,1 弃权。有关会议讨论的详细报道请见【快讯】Mode...
|
|
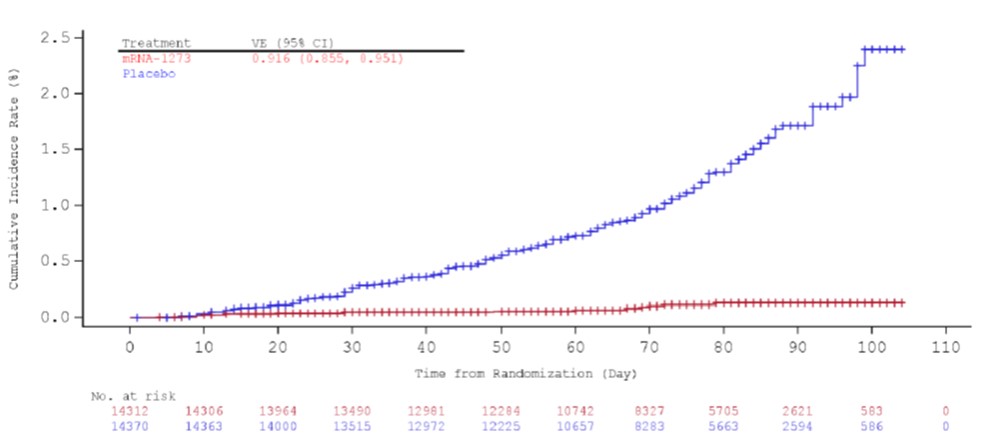
【快讯】Moderna 新冠疫苗专家会意见,20-0 支持紧...
2020.12.18
北京时间 12 月 18 日早 6 点 10 分,美国 FDA 就 Moderna 新冠(COVID-19)疫苗 mRNA-1273 的紧急使用授权(EUA)召开的专家会刚刚结束。在结束了一整天 8 个多小时对 Moderna 新冠疫苗的广泛讨论后,外部专家以 20 赞成,0 反对,1 弃权,认为基于可用全部科学证据,Moder...
|
|
欧盟新冠疫苗专家投票日期提前,使用附条件批准路径
2020.12.17
欧洲药品管理局(EMA)迫于政治压力预期将在下周就首个新冠(COVID-19)疫苗给出附条件上市批准建议。
EMA 之前计划“最迟”在 12 月 29 日之前就辉瑞/BioNTech 的 COVID-19 疫苗 BNT162b2 做出决定,但现在将这一决定提前至 12 月 21 日。EMA 专家的预期投票结果将...
|

|
FDA 发布仿制药研发受控函定稿指南
2020.12.17
美国 FDA 于 12 月 16 日发布《与仿制药研发相关的受控函》定稿指南。受控函(controlled correspondence,CC)是向 FDA 询问有关 Q1Q2、批次大小或括号法策略、非活性成分水平,甚至是一般性的批准后提交要求的工具,方便易用,可以让企业了解 FDA 对于企业具体研发产品的期...
|

|
免费线上讲座(中文翻译):FDA 生物制品研发、合规...
2020.12.16
【识林-Hogan Lovells】FDA 生物制品法规:法律框架与合规优先事项, 2020.12 link=13px
美国 FDA 生物制品法规框架如何?监管要求、批准途径和专营权方面与我们日常所熟悉的小分子药品有何区别?生物制品的制造与合规挑战如何?生物制品场地常见检查观察项的前车之鉴有哪些...
|
|
Moderna 新冠疫苗专家会会前资料,非常有效但不良反...
2020.12.16
美国 FDA 于周二(12月15日)发布了针对 Moderna 新冠(COVID-19)疫苗紧急使用授权(EUA)的专家咨询委员会(advisory committee)的部分会前资料,FDA 审评科学家认为该疫苗安全有效。
在计划于本周四召开的疫苗和相关生物制品咨询委员会会议上,外部专家将投票表决 Moderna COVI...
|

|
欧洲药品监管 2025 战略关注药品可及性和供应链挑战
2020.12.15
欧洲药品管理局(EMA)和欧盟药品机构(HMA)于 12 月 8 日发布了《2025 药品监管网络战略》,对于未来五年的欧盟药品监管网络,药物可及性和可获得性被列为首要议题,其次是创新、供应链挑战、抗菌素耐药性等问题。
与战略同时发布的还有对战略草案征求意见结果的分析和总结,战...
|

|
新全球联盟推动分散式临床试验的实施
2020.12.15
12 月 10 日,一个新的国际联盟 — https//dtra.org/dtra-launches-to-democratize-and-accelerate-clinical-trials/ 分散式试验与研究联盟(DTRA)启动,目的是解决整个研究界利益相关者在有意义地采用分散式试验方面持续面临的“重大障碍”。目前成员有 50 个组织,包...
|

|
【一周回顾】2020.12.07-12.13
2020.12.14
国家局就药品年度报告管理规定和报告模板公开征求意见。药审中心发布药物研发与技术审评沟通交流管理办法,公开ICH 指导原则培训视频与课件资料。FDA 召开疫苗专家会,颁布首个新冠疫苗紧急使用授权。欧盟发布药品监管网络 2025 战略。ICH 就启动以患者为中心的药物开发指南制定征...
|