
|
Teva 因首仿申请人定义变化波及自身利益起诉 FDA
2018.10.27
Teva 制药公司向美国 FDA 提起诉讼,旨在为其环孢菌素眼药水仿制药争取 180 天的专营权,并希望撤销 FDA 重新定义“首个申请人”的新政策。该药原研参照产品为 Allergan 公司 Restasis。
Teva 的起诉是针对 FDA 于 7 月 10 日发布的一封信函,该信是发给 Indivior 公司的 ...
|

|
FDA 局长谈即将推出的药物软件组合平台
2018.10.26
美国 FDA 预计将很快发布其数字医疗工具平台,该平台将允许软件应用程序与新药一起获批并包含在新药标签中。
根据计划,这些软件应用程序可能不需要 FDA 器械与放射健康中心(CDRH)的批准。FDA 局长 Scott Gottlieb 于 10 月 14 日在 Milken 研究所未来医疗峰会上表示,...
|

|
11月 识林线下交流会
2018.10.25
识林线下交流会—仿制药开发的关键点和决策评估
本次我们邀请到 Garth Boehm 博士与大家交流ANDA项目进展到何种程度、时间节点的决策评估要素,每个步骤的风险点以及风险控制策略。活动时间11月3日下午130-430,地点在北京大学中关新园。
我们会安排翻译,请大家放心报名...
|

|
生似药在美上市艰难征程上又迈一步
2018.10.23
品牌药商或难靠有偿延迟手段推迟生似药在美上市。美国国会最近通过的一项法案中一条几乎无人关注的条款将使得制药商更难以达成可能会阻止生物类似药进入市场降低美国医疗保健成本的所谓的有偿延迟(pay-to-delay)交易。
隐藏在《患者知情权法案》(Patient Right to Know Act)...
|
|
吸入制剂与统计建模方法报告会
2018.10.22
吸入制剂与统计建模方法报告会
北京大学 2018年11月28日 (首轮通知)
会议目的
吸入制剂的复杂性体现在装置及其与药品的结合上。成功研发这类复杂产品,即使是仿制产品,都是全球公认的难题。机械装置的研发与传统药品的研发相差深远,我国与国际差距大。为提高吸入制剂...
|

|
FDA 向 ICH 提议协调全球仿制药批准标准
2018.10.20
美国 FDA 于 10 月 18 日宣布正在向 ICH 提出一项建议更好地协调仿制药的科学和技术标准。该提议旨在允许仿制药研发商实施单一的全球药物研发计划以及提交申请的通用要素,以在多个市场同时批准。
FDA 局长 Scott Gottlieb 表示,“这将使原本只在一个地区寻求仿制药批准的...
|

|
2018 秋季统一议程:FDA 推进健康与安全的新监管工...
2018.10.19
(译自 FDA Voice https//www.fda.gov/NewsEvents/Newsroom/FDAVoices/ucm623619.htm “Fall 2018 Unified Agenda FDA's New Regulatory Work to Advance Health and Safety” 2018 年 10 月 17 日,作者:Scott Gottlieb,医学博士,美国 FDA 局长)
2018 年...
|

|
国际药品危机事件管理的法律、商务和技术考虑
2018.10.18
IPEM – 识林 专题课 (第二轮通知)
国际药品危机事件管理的法律、商务和技术考虑
2018年11月9-10日,北京
识林资讯 2018年9月30日,发布了专题课的首轮通知,及课程背景介绍。部分读者希望进一步了解课程细节,本篇资讯应此而生。
专题课将从商务、法律、公众和政...
|

|
FDA 2018 财年仿制药批准再创纪录
2018.10.16
美国 FDA 仿制药办公室(OGD)2018 财年批准了 781 件 ANDA,打破了 2017 财年 763 件批准的历史记录,同时还有 190 件暂时批准,共 971 件批准,也创下了新的批准记录。这是一个好迹象,表明随着 GDUFA II 期第一个财年的结束,仿制药批准工作正在朝着积极的方向发展。
FD...
|
|
FDA-DIA 复杂药械组合产品研讨会简报
2018.10.15
https//www.fda.gov/Drugs/NewsEvents/ucm617128.htm FDA/DIA 复杂药械组合产品研讨会于 10 月 9 -10 日在美国 Silver Spring 召开。会议第一天涉及这类产品仿制药提交的监管内容,并讨论了与复杂仿制药相关的临床内容,重点是吸入产品。
FDA 演讲者重点关注的话...
|
|
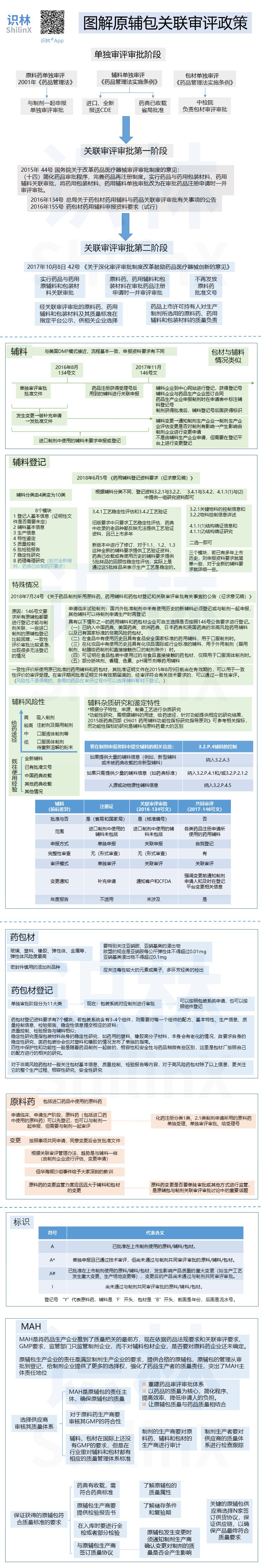
图解原辅包关联审评政策
2018.10.13
作者:识林-樟
识林®版权所有,未经许可不得转载。如需使用请联系 admin@shilinx.com 。
...
|

|
FDA 针对透皮仿制药发布系列指南
2018.10.12
美国 FDA 于 10 月 9 日发布了两篇有关透皮和外用递药系统(TDS)仿制药的指南,同时还发布了 25 篇针对外用和透皮产品的具体产品生物等效性(BE)指南,其中 2 篇新指南,23 篇修订指南。这些 BE 指南涉及具体产品所需的 BE 研究以及支持 BE 所必需的黏附性以及刺激性和致敏...
|

|
FDA 受控函提交更方便,但能否真正解决问题?
2018.10.10
2018 年 10 月 1 日,美国 FDA 允许企业通过门户网站(CDER Direct NextGen Collaboration Portal)直接向 FDA 电子化提交受控函(CC,Controlled Correspondence ),并发布了包括如何注册使用门户网站的指导。这可能有助于加快向 FDA 提交受控函的速度,但是提交到 FD...
|

|
无进展生存期能否反映患者生存质量?
2018.10.09
尽管无进展生存期越来越多地用于癌症药品的临床试验,但一项新研究表明,这种方法并不一定能反映患者生存质量的改善。
一项研究1分析了 2000 年到 2016 年间涉及近 14000 名(患有 12 种不同形式癌症)患者 38 个随机临床试验的 52 篇文章,发现当疾病没有恶化时,健康相关...
|

|
国际药用气雾剂联盟点评 FDA 最新指南
2018.10.08
2018年9月13日-14日,由美国药学科学家协会中国讨论组(America Associate of Pharmaceutical Scientists China Discussion Group,AAPS CDG)和国际药用气雾剂联盟(International Pharmaceutical Aerosol Consortium on Regulation & Science, IPAC-RS)主办的“AAPS CD...
|

|
全球最权威医学杂志思考何去何从
2018.10.06
《新英格兰医学杂志》(NEJM)集团于上周四宣布,NEJM 总编 Jeffrey M. Drazen 博士将在明年退休。为了确保顺利过渡,Drazen 博士将继续领导期刊和 NEJM 集团,直到任命继任者为止。这一宣布,为世界上最负盛名的医学期刊带来新视角,创造了机会。
Drazen博士于 2000 年出任 N...
|

|
关键性临床试验成本可能并没有想象的那么高
2018.10.05
一项新研究表明,获得监管批准所需的关键性临床试验的中位数成本仅为 1900 万美元。换而言之,用于说服 FDA 批准新药的关键科学证据只占整体研发成本的一小部分,
根据发表在 JAMA Internal Medicine 上的研究1 显示,此类试验的最低成本从用于罕见代谢紊乱药物的四名患者试验的...
|

|
美墨加贸易协定为生物制品设定十年专营权
2018.10.04
新的美国-墨西哥-加拿大贸易协定规定,生物制品在产品“首次上市批准之日起至少 10 年内”拥有市场保护。
《美国生物制品价格竞争和创新法案》(BPCIA)规定,生物类似药申请必须在参照产品首次获得许可之日起 12 年之后才能获得批准。贸易协定不会改变这一规定,但会让将保护期缩...
|

|
复杂仿制药历史是由参与者书就的
2018.10.02
9 月 5 至 7 日,GRx+Biosims 会议在美国马里兰州巴尔的摩举行,会议的最后一天是 FDA 主持的关于复杂产品 GDUFA II 期 ANDA 前计划的内容。
仿制药办公室(OGD)研究与标准办公室监管事务副主任 Kris Andre 详细讨论了与复杂仿制药会议相关的组织工作和 FDA 的期望。...
|

|
专题课 - 国际药品危机事件管理的法律、商务和技术...
2018.09.30
IPEM-识林 专题课 (首轮通知)
国际药品危机事件管理的法律、商务和技术考虑
北京大学中关新园1号楼科报厅 2018年11月9-10日
今年夏天,我国一家出口药企因原料药杂质问题而引发全球产品召回的危机。本周,美国和欧盟全面禁止其产品进口,形成了一个复杂的监管合规...
|