
|
制药行业热捧罕见病用药,FDA 被指有悖《罕见病用药...
2018.12.05
美国政府问责办公室(GAO)于近日公布题为《罕见病用药:FDA应提高罕见病用药认定审评一致性;罕见病用药研发挑战犹存》的报告。报告显示,随着制药商竞相热捧罕见病用药认定,FDA并没有能够持续记录和评估所需信息。报告称,FDA未能确保罕见病用药认定符合《1983年罕见病用药法案》的初衷...
|

|
ICH 仿制药标准:知易行难的计划
2018.12.04
美国FDA在今年十月间宣布向国际人用药技术要求协调会(ICH)提交了一份制定全球通用的仿制药标准的方案。这一方案是FDA局长Gottlieb提出的旨在解决仿制药行业中药品竞争和可及性问题《药品竞争行动计划》(Drug Competition Action Plan)中的另一项战略。【FDA 向 ICH 提议协调全球...
|

|
BE 做到一半,FDA 又修订了产品 BE 指南!
2018.12.03
勤劳的FDA同行们,刚过完感恩节假期就马不停蹄地更新了41份产品BE指南的修订稿和22个新增的产品BE指南 (Product Specific Bioequivalent Guidance),这是近3年来单次发布修订数最多的一次。仅仅2018年(截止到11月30日),FDA发布了6次产品BE指南的新增和修订,总共新增127个产品BE指南...
|

|
【更新提示】识林一周回顾(20181125-1201)
2018.12.02
【IPEM】12月课程通知(12.01)
!上课日期
!时间
!授课老师
!课程主题
!上课教室
!授课方式
12月13日
(周四)
0830-1130
梁 冰
裘行敏
药物警戒与不良反应
监测系统
中关新园1号楼 二层科报厅
中文
1300-1700
12月14日
(周五)
0830-1130
1300-1700
...
|

|
印度 CRO Semler 就数据可靠性问题起诉 FDA 后续:...
2018.12.01
今年1月份识林曾发布资讯,印度合同研究机构(CRO)Semler 研究中心因美国 FDA 公开“莫须有的”数据欺诈问题破坏了其声誉并造成其业务损失而起诉 FDA。1 日前,FDA 对于该起诉做出回应表示,该诉讼应被驳回,因为诉讼可能破坏 FDA 的公共卫生使命和《联邦食品、药品和化妆品法案...
|

|
一些临床试验可能推动使用无效、昂贵的治疗药物
2018.11.30
加拿大麦吉尔大学学者在JAMA Internal Medicine上新发表的一篇论文显示,一些临床试验可能推动使用无效和昂贵的治疗方法。这样的做法,与临床试验防止医生和患者接受无效和昂贵治疗的目标背道而驰。
研究者将注意力集中在重磅炸弹式药品普瑞巴林(Lyrica)上。普瑞巴林是全球最畅销药...
|

|
FDA 局长:瞄准 CRO 过时流程,推动临床试验数字化
2018.11.29
美国FDA局长Scott Gottlieb表示,更好地利用数字工具来捕获和审计数据,有助于降低研发成本,敦促大家摒弃合同研究组织(CRO)从旧的做事方式中获利的过时的手工流程,推动将药物开发和监管完全纳入数字时代。
更多利用数字技术
在11月19日Reagan-Udall基金会扩大会议上讲话时,Gottli...
|

|
数据可靠性带来了爱克龙的“凛冬”
2018.11.28
爱克龙再次因质量管理被FDA发出483信:
爱克龙(Akorn)是一家美国仿制药生产企业,专注于生产眼科用药,注射剂,口服液,耳药,局部药,吸入剂和鼻腔喷雾剂等。它的研究和生产设施分布在美国、印度及瑞士。仅在今年,其下属的两个生产设施(分别位于新泽西州萨摩赛特和伊利诺伊州迪凯特...
|

|
FDA 对于 Teva 环孢菌素仿制药首仿专营权诉讼的回...
2018.11.27
上个月识林的一篇资讯1 介绍了 Teva 制药起诉美国 FDA,希望争取起环孢菌素眼药水的首仿 180 天专营权,并让 FDA 撤销对于“首个申请人”的新定义。今天让我们来看看 FDA 对此案的反应。
FDA 严厉质疑了 Teva 认为其环孢菌素眼药水拥有 180 天专营权的主张,表示 Teva 可...
|

|
FDA 局长及药品中心主任再谈药品短缺解决之道
2018.11.26
【编者按】美国 FDA 局长与药品中心主任日前在 FDA Voice 上发表联名文章,介绍 FDA 在药品短缺方面过去、目前与将来的努力,讨论了短缺问题的深层次原因,并号召各界参与协作,共同解决问题。
我们公共卫生使命的一个关键组成部分是帮助确保美国民众获得安全有效的药品。这就是...
|

|
【更新提示】识林一周回顾(20181118-1124)
2018.11.25
【案例】中药提取工艺验证(11.23) 材料清单
本文对中药提取验证以流程图形式呈现,描述了前处理,净制,筛选,浸润,干燥(药材烘干)等31个项目,并且将中国GMP指南等参考文献中的法规要求,工艺中的目的,操作,阐述,注意点以及示例,设备等相关内容进行整理,形成一份材料清单,...
|
|
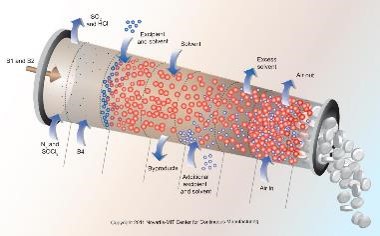
FDA 采用更多建模工具支持连续制造
2018.11.24
在日前举行的ISPE年会和美国制药科学家协会会议上, FDA官员提到连续制造的“不断增长的牵引力”以及更多使用建模支持这种制造模式,同时说明在检查过程中如何评估这些模型。FDA官员报告,制药行业对使用工艺过程建模工具支持连续制造越来越感兴趣。在与FDA举行的会议上,申请人纷纷显示...
|

|
从“第五条腿”说起,说到赢得 FDA 信任
2018.11.23
上周识林-柯的文章讲美国法庭被告席“座椅”的“四条腿”(无过失责任,集体诉讼,律师胜诉酬金,陪审团审判),今天再加“一条腿”,即举报人(whistleblower)条款,并由此引申到赢得FDA的信任和相关话题。
在IPEM-识林于9月3日和11月10日举办的“危机管理”讨论会和专题会上,...
|

|
Buhay 先生与 GMP 说文解字
2018.11.22
2018年11月22日 北京大学IPEM硕士项目 郑强
今天是美国感恩节,我来分享Buhay先生对GMP的一些认知,以表达对他的感恩。这些认知,不是为了解决手上急活,而是为了促进对GMP理念的进一步思考。
【Nicholas Buhay先生今年73岁,在政府供职40年后,于2009年从FDA退休。他曾长期从事药品...
|
|
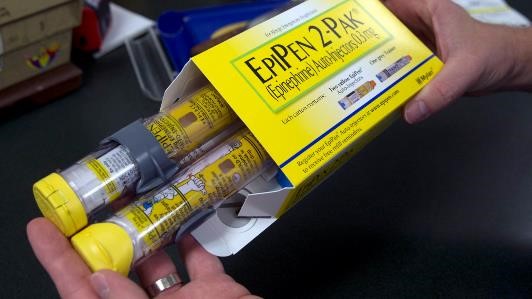
两支售价数百美元的 EpiPen 仅值 24 美元?
2018.11.21
一支 EpiPen 真正价值几何?根据一项基于成本效益基准的分析1 表明,一盒两支装用于抗过敏的肾上腺素自动注射器 EpiPen 的价值仅为每年 24 美元。
这篇发表在 JAMA Network Open 上的研究使用模拟模型,通过假设 EpiPen 与类似药械组合产品可以使花生过敏的死亡风险降低 1...
|

|
重击辉瑞,利好仿制药:英国法院裁定普瑞巴林第二项医...
2018.11.20
英国最高法院裁定辉瑞公司普瑞巴林在治疗神经性疼痛方面的第二项医疗用途专利无效。这一裁决对辉瑞公司是个坏消息,但对涉及的仿制药公司来说却是利好,裁决可能意味着品牌公司未来必须提供更多证据来证实其专利权利要求。这份裁决会成为很多讨论和学术辩论的主题。
英国法院裁定普瑞巴...
|

|
FDA 药品中心主任谈药品审批变革及前景
2018.11.19
美国 FDA 药品审评与研究中心主任 Janet Woodcock 于 11 月 14 日在预见政策(Prevision Policy)生物制药大会上表示,从之前的消极行事到现在积极主动以新颖的方式利用生物科学的一系列科学革命,FDA 在过去几年间发生了很大变化。
实时审评
关于 FDA 的变革与前景,Woodc...
|

|
【更新提示】识林一周回顾(20181111-1117)
2018.11.18
【梳理版】药品出口销售证明管理规定(11.17) 原文
11月13日,国家药品监督管理局发布了《药品出口销售证明管理规定》。本文将《药品出口销售证明管理规定》的内容从管理办法的实施时间,适用范围,办理方法,申请资料等方面进行梳理,帮助读者深入理解。
【DIA】 ICH E2B R3...
|
|
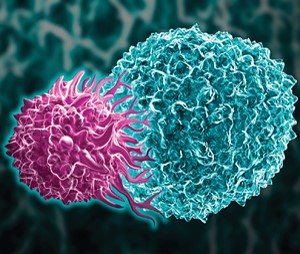
无法获得报销,高价 CAR-T 疗法何以为继?
2018.11.17
【编者按】CAR-T 等基因治疗药物的面世的确振奋人心,但医院在实际使用中也面临着无法绕开的问题:成本。患者希望紧紧抓住这一线治愈的希望,而支付方目前尚不能拿出有效的报销方案。报销问题同时也可能会对这类药物未来的研发产生消极影响。
在 11 月 14 日哈佛医学院举行的个...
|

|
一不小心成被告:中国药企在美国“四条腿”的被告座椅
2018.11.16
【编者按】数据可靠性(DI)引起的进口禁令和警告信危机还未趋缓,原料药杂质引起的全球产品召回危机又至。在这种复杂的形势下应如何未雨绸缪、积极防范和应对,这是我们连续举办两次危机管理主题专题课和学习会的目的。我们将分几篇文章介绍会议内容,以供更多感兴趣的读者阅览。
被...
|