
|
国际药政每周概要:FDA药品生产中的人工智能,靶向病...
2023.03.07
【监管综合】
03.01【FDA】药品生产中的人工智能
02.28【EMA】质量创新小组(QIG)2023年工作计划
03.03【FDA】监管者视角:FDA 为继续确保国家药品供应安全而采取的行动
【注册、审评、审批】
【创新研发与临床】
03.01【FDA】指南草案 靶向病毒病原体的单克隆...
|
|
美疾控中心就止咳糖浆死亡事件发布调查报告,责任归咎...
2023.03.06
美国疾病预防与控制中心(CDC)于 3 月 3 日发布对西非冈比亚儿童因肾损伤死亡的调查报告 表明,这些死亡与印度 Maiden 药业生产的受污染咳嗽糖浆之间存在密切联系。
调查是由 CDC 和冈比亚卫生部共同开展的。报告指出,“调查强烈表明,进口到冈比亚的受二甘醇(DEG)或乙二醇...
|

|
国内药政每周导读:第八批国家集采启动,国务院发中医...
2023.03.06
【创新药与临床开发】
2.27,【卫健委】关于印发涉及人的生命科学和医学研究伦理审查办法的通知
【注册、审评、审批】
3.05,CDE 药品审评报告和说明书更新
【政策法规综合】
2.28,【国务院】关于印发中医药振兴发展重大工程实施方案的通知
3.01,【国家医疗保障局...
|

|
【周末杂谈】狼可能要来了
2023.03.05
FDA正在猛查印度药企,也许下一步就轮到查我国药企了?
一周多前,以主题为“监管期望:质量优势”的PDA India 2023年会在印度科技重镇班加罗尔举行。会开得很紧凑,仅1天半,却有8个部分和22位讲者。
1. 开幕式和主题演讲
2. 检查、记录索要和与监管机构沟通
3. 内部...
|

|
轻松一刻 - 失而复得的预算
2023.03.04
识林轻松一刻,意在以漫画形式,展现药企人酸甜苦辣,博得识林读者会心一笑之余,也希望带来些许回味与思索。
识林欢迎读者提供素材,可以是几段对话,也可以是一个故事。有合适的,识林会与您联系,一起优化完善,并由我们的设计师转化为漫画,在识林平台上分享给大家...
|

|
FDA 仿制药办公室发布 2022 年年报
2023.03.03
美国 FDA 仿制药办公室(OGD)发布了其2022 年年度报告,概述了其在这一年中的成就,包括 2022 年仿制药使用者付费第III次迭代立法(GDUFA III)获得国会重新授权,数百个仿制药(包括复杂仿制药)的批准以及扩大国际合作等。
请注意这份报告是基于日历年度而不是财政年度,所以...
|
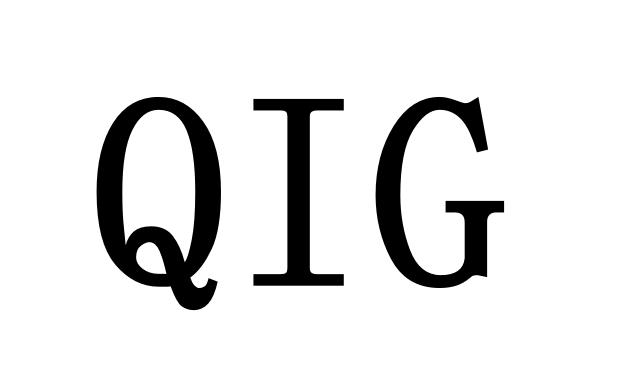
|
欧盟质量创新小组2023年工作重点:连续制造、分散式制...
2023.03.03
昨日我们介绍了美国 FDA“药物生产中的人工智能”讨论文件,了解了 FDA 对新技术的考量。今天我们来看看欧洲药品管理局(EMA)于 2 月 28 日发布的质量创新小组(Quality Innovation Group,QIG)2023 年工作计划,计划中介绍了 EMA 对于新技术的思考。
QIG 是支持开发、...
|

|
2022年美国的肿瘤药物批准:注重总生存期、剂量优化及...
2023.03.02
本周FDA肿瘤卓越中心主任Richard Pazdur,血液肿瘤办公室主任Nicole Gormley和临床审评员(淋巴瘤)Deepti Telaraja,在《Nature reviews clinical oncology》上发表了一篇评论,总结了2022年美国的肿瘤药批准。在2022年,FDA批准了多种新的药物和生物制品,其中包括靶向小分子药物...
|

|
FDA 发布药物生产中的人工智能讨论文件,就 AI 在...
2023.03.02
美国 FDA 于 3 月 1 日发布了一份题为“药物生产中的人工智能”的讨论文件,为利益相关者提供信息并就新兴和先进制造技术的特定领域公开征求意见。讨论文件介绍了 FDA 药品审评与研究中心(CDER)与人工智能(AI)在制药生产中的应用相关的科学和政策专家确定的需要考虑的领域和政...
|

|
FDA迟迟不做为,非营利组织提交公民请愿敦促FDA加强对...
2023.03.01
非营利组织北美基本药物大学联盟(UAEM)于 2 月 27 日向美国 FDA 提交公民请愿,要求 FDA 采取多项措施,加强对未能登记研究和报告结果的临床试验申办人和研究人员的执法行动。
UAEM 在其请愿中指出,FDA 在执法方面做得非常糟糕,以至于不合规情况“仍普遍存在”,并且那些...
|

|
ICH 将于明年初定稿 M12 药物相互作用研究指南
2023.03.01
ICH 于去年 7 月开始就 M12《药物相互作用研究》公开征求意见,制药行业在其反馈意见中希望更清楚地了解药物相互作用(DDI)研究的时间安排和 DDI 研究的范围。
2 月 24 日美国 FDA 和加拿大卫生部主办的 ICH 区域会议上,FDA 药理学办公室指南和科学政策副主任兼 M12 工作组成员 R...
|

|
ICH 稳定性系列指南将合并为一个 Q1 指南
2023.02.28
ICH 质量讨论小组(QDG)在对现有质量指南进行全面评估,并考虑到未来可能出现的议题后,向ICH管委会发布了题为“ICH质量指南的未来机遇与现代化:ICH质量思考文件中ICH质量愿景的实施”的报告。根据QDG的评估和建议,Q1A-F/Q5C稳定性指南系列的维护被确定为最高优先事项之一。
QDG...
|

|
国际药政每周概要:英国对含伪麻黄碱药品的安全性审查...
2023.02.28
【注册、审评、审批】
02.21【FDA】MAPP 5016.6 硬胶囊壳供应商的变更
【创新研发与临床】
02.24【FDA】指南草案 新生血管性年龄相关性黄斑变性:开发治疗药物
【GxP 与检查】
【安全性】
02.23【MHRA】MHRA 对含伪麻黄碱药品的安全性审查
02.22【WHO】医疗产...
|

|
国内药政每周导读:非无菌化药微生物限度,合成多肽药...
2023.02.27
【创新药与临床开发】
2.21,【CDE】关于发布《成人2型糖尿病药物临床研发技术指导原则》的通告(2023年第10号)
【CMC与仿制药】
2.20,【CDE】关于发布《化学合成多肽药物药学研究技术指导原则(试行)》的通告(2023年第12号)
2.21,【CDE】关于发布《非无菌化学药...
|
|
FDA 或将于年底开始检查供应链安全,GMP 与供应链合...
2023.02.27
美国 FDA 前官员最近表示,制药商及其贸易合作伙伴应确保分销系统完全遵守《药品供应链安保法案》(DSCSA),一旦该法案于今年 11 月份全面生效,FDA 将开始在检查中增加对供应链安全的合规性审查。
Arnold & Porter 律所合伙人、FDA 前全球监管运作与政策的副局长 Howard Sklamb...
|

|
【周末杂谈】美国药物供应本土化的讨论
2023.02.26
近期发表的有关药物供应本土化关注点和实操性的两项研究
这周四,识林资讯介绍了美国约翰霍普金斯大学Mariana Socal等研究者们本月发表的题为“美国仿制原料药全球供应链的竞争和脆弱性”的文章。两周前,美国普享药协会(AAM,前身是美国仿制药协会)副主席Jonathan Kimball在微博上...
|

|
【识林新课程】美国业界看欧盟无菌附录,483回复,DMF...
2023.02.25
识林升级版用户,可在PC端和App、小程序移动端学习28个模块的420+门课程3000+节视频,涉及药品研发、注册、生产、质量等全生命周期,包括IPEM项目部分精华课程摘要,监管和学术机构专题教学和研讨会,及供应商技术介绍专业课程。除视频内搜索,收藏,评论功能外,部分原声视频实现双语...
|

|
【识林新翻译】FDA的PFDD,ANDA回应函,新加坡细胞GMP...
2023.02.25
中外法规指南浩如烟海,为帮助用户跨越语言关,加深理解,识林将努力为识林企业用户提供法规指南翻译,并尽我们所能确保质量。
专业水平所限,差错难免,也希望企业用户在阅读学习的同时,在页面评论区提问、纠偏,企业用户还可联系我们提出法规翻译需求。
此外,识林还推出“双...
|
|
文献 药品中亚硝胺杂质的根本原因和风险因素的监管经...
2023.02.24
此篇文献从质量角度分享当前有关亚硝胺杂质的根本原因、风险因素、风险缓解和控制策略的建议和经验,作为李敏博士3月4-5日“药物降解化学、杂质研究与指示稳定性分析方法开发;药物申报难点与策略”的课前读物,分享给各位同学!
摘要
N-亚硝胺(也称为亚硝胺)是一类物质,其...
|

|
美参议院委员会通过多项药品专利改革法案,但前景不明
2023.02.24
美国参议院司法委员会于 2 月 9 日通过了一系列五项立法,旨在降低处方药成本。
第一项“患者可负担处方药法案(S. 150, Affordable Prescriptions for Patients Act of 2023)”,防止制药公司利用专利制度来延迟更便宜的仿制药的竞争。
这项立法措施旨在通过限制专...
|