
|
FDA仿制药办公室发布首份年度报告
2016.04.14
仿制药为所有美国公众提供了更多的医疗保健机会。
对于FDA药品审评与研究中心(CDER)仿制药办公室(OGD)来说,2015年是重要的一年。这是我们在极大地扩展办公室的范围和构架成为“超级办公室”后的第一个完整年度。这一改变使得办公室具有更加重要的地位,并拥有更多的工作人员处理日...
|

|
FDA:连续制造强化药品质量
2016.04.13
编者按:FDA上周五首次对已上市产品批准其制造商使用连续制造的方式生产,这标志着连续制造方面里程碑式的发展,体现了FDA对先进制造技术的支持和重视。这一生产方式转换的获批,对现有已获批产品如何由传统制造向连续制造转换提供了参考,并建立了新的监管路径。
(摘自FDA Voice “Co...
|

|
FDA局长在处方药滥用峰会上的演讲
2016.04.12
美国FDA局长Robert Califf医师3月29日在2016全国处方药滥用和海洛因峰会上的演讲概述了FDA应对阿片类药物滥用流行的计划,并谈到了许多重要和关键的问题,强调了摆在面前的艰苦工作。他强调,需要有涉及从业者、其他医疗服务提供者、执法人员、教育工作者和患者的多管齐下的方法。
他强...
|

|
FDA发布专利名评估的完整提交内容定稿指南
2016.04.09
在药品获得美国FDA批准前,FDA会仔细审查拟定的专利名称。一个专利名看起来和听起来都不像另外一个专利名对于安全性原因是重要的。如果一个新的处方药的专利名与一个现有处方药的专利名相似,在分发时可能会发生混淆,患者可能拿到另一种药品而不是应该使用的那个药。FDA药品审评和研究中...
|

|
FDA 2016财年3月ANDA批准数据
2016.04.08
仿制药办公室(OGD)3月完全批准63件ANDA,暂时批准16件ANDA,成为本财年完全批准量第二高的月份,也是GDUFA后完全批准量第二高的月份。我们希望看到批准行动超过接收量,但出乎意料,OGD 3月收到115件ANDA。
我们之前认为ANDA接收和批准之间达成的平衡现在似乎已经朝着接收那边倾斜。...
|

|
FDA发布OTC历时及覆盖范围申请(TEA)拟议规定
2016.04.07
4月4日FDA发布关于非处方药(OTC)历时及覆盖范围申请(TEA,Time and Extent Applications)的拟议规定专论的申请机制。TEA现在是1972年OTC审查开始以后首次在美国上市的产品和没有美国上市经验的产品添加进OTC专论的最优选择。
新的拟议规定是实施2014防晒剂创新法案(SIA)的一部...
|
|
FDA批准英利昔单抗生物类似药Inflectra
2016.04.06
4月5日,美国FDA宣布批准了Inflectra (infliximab-dyyb)的多个适应症。这是美国FDA批准的第二个生物类似药,首个单克隆抗体生物类似药。
Inflectra是由韩国 Celltrion 公司开发,并将由美国的 Hospira 公司上市销售(辉瑞于去年收购了Celltrion的商业合作伙伴Hospira)。参照药品...
|

|
2016卓越运营研讨会
2016.04.06
北京大学国际药物工程管理(IPEM)项目与瑞士St. Gallen大学技术管理研究院合作举办第二届药业卓越运营(OPEX)研讨会,欢迎企业管理者、生产管理者和OPEX负责人及其他相关人士参会。
时间:2016年5月9日(周一)
地点:北京大学英杰交流中心第二会议室
语言:英文报告+中文...
|

|
EMA发布《儿科药物开发中安全性和有效性的数据外推》...
2016.04.05
-从成人数据外推儿科数据,以促进儿科用药的发展
欧洲药品管理局(EMA)已经发布了《儿科药物开发中安全性和有效性的数据外推》意见稿(Reflection paper on extrapolation of efficacy and safety in paediatric medicine development),列出了成人临床数据外推到儿科的...
|

|
Amgen提请最高法院拒绝Sandoz对商业上市通知规定的挑...
2016.04.04
2016年3月21日,Amgen递交答辩书(certiorari cross-petition),要求:如果法院决定审查商业上市通知规定,也应该审查和推翻联邦巡回上诉法院关于专利之舞信息交换条款是可选的裁决。此案涉及首个且是唯一一个在美国获批的生物类似产品 — Sandoz的filgrastim产品Zarxio,其参照Amgen的f...
|

|
ANDA批准函中的提交日期消失
2016.04.02
大约一周前,我开始收到关于仿制药办公室(OGD)批准信格式变化的电话和反馈。最初可能是一个微小变化,令许多企业感到不满,同时也代表了另一个没有警告或不加解释而发生的“透明性”过失。以下是来自2封ANDA批准函开头的句子。阅读这两句话,请看在示例B中缺少了什么。
示例A
This ...
|

|
CHMP建议批准基因治疗产品Strimvelis
2016.04.02
--EMA建议批准儿童罕见免疫系统紊乱疾病的基因治疗
编者按:欧美药监部门批准的基因治疗产品是很少的。美国FDA官网表述:CBER还没有批准任何商业销售的人用基因治疗产品。但是,美国基因治疗相关的研发是快速增长的,CBER收到了很多基因治疗的申请,CBER为新型产品的开发提供了很多...
|
|
FDA发布生物类似药标签指南草案
2016.04.01
3月31日FDA发布生物类似产品标签指南草案,尽管生物制品企业会很高兴看到标签中对生物类似药和参照产品的一些澄清,但该指南草案很大程度上依赖于参照生物制品的标签指南。
指南草案中,FDA明确指出,生物类似产品标签不应包括仅支持证明所提生物类似产品和参照产品对于获批适应症无临...
|

|
FDA新任局长:工作重点 - 协力实现共同目标
2016.03.31
(摘自FDA Voice “Priorities – Teamwork to Achieve Common Goals” 2016年3月30日,作者:Robert Califf,医师,FDA局长。)
随着我就任食品药品管理局(FDA)局长而来的,是充满渴望和谦逊恭谨的机会 — 在这个对国家和公民做出极其重要工作的机构,产生积极的影响。...
|

|
FDA和NIH发布临床试验方案模板草案
2016.03.30
3月17日FDA和美国国家卫生研究院(NIH)发布临床试验方案模板草案并向公众征求意见。模板草案由NIH-FDA联合领导委员会(JLC)编制,包含指导和示例文本,用于需要研究用新药(IND)或研究用器械豁免(IDE)申请的研究人员撰写II期和III期临床试验方案。
为方便研究人员编写,模板草案...
|

|
FDA将关闭蛋白质类产品的NDA、ANDA途径
2016.03.29
2016年3月11日FDA发布题为《2009生物制品价格竞争与创新法案“认定为(BLA)许可”条款的实施》的指南草案。2020年3月23日,大概4年后,按照NDA途径获批的蛋白质类产品将失去FD&CA 505途径赋予的专营权。截至该日期,按照NDA途径申请的蛋白质类产品,如果仍未获批,将会失效。对于蛋白质...
|

|
【更新提示】药政信息摘要2016.03
2016.03.29
CFDA非法经营疫苗案件查处:
总局办公厅关于对山东济南非法经营疫苗案有关线索开展调查的通知(03.23)
李克强对非法经营疫苗系列案件作出重要批示(03.22)
食品药品监管总局 公安部 国家卫生计生委关于共同做好非法经营疫苗案件查处工作的通知(03.21)
...
|
|
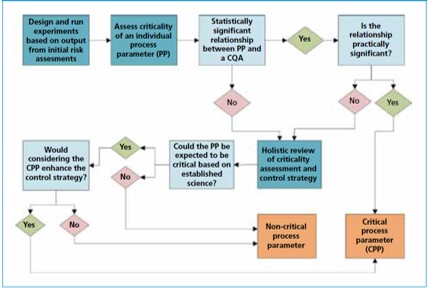
持续工艺确证中评估关键工艺参数的统计学方法
2016.03.28
在药品制造中,确保工艺处于受控状态并被确证是对公众健康和监管机构都是非常重要的因素。为此,持续工艺确证(CPV)被定义为常规商业化制造工艺的不断监测以确保在性能确认后持续在受控状态运行。这是2011年FDA指南中描述的工艺验证的生命周期方法的组成部分。此外,在2015年,许多其它监...
|

|
FDA发布阿片类仿制产品滥用遏制指南草案
2016.03.26
3月25日FDA发布《行业指南草案 –仿制固体口服阿片类药品的滥用遏制评价一般原则》,随着指南草案的发布关于滥用遏制仿制产品的一些问题变得更加清晰。指南草案描述了仿制药申请人在寻求参照药品(RLD)在标签中具有滥用遏制属性描述的阿片类产品的批准时应开展的实验类型(可比性体外研...
|

|
FDA对速释阿片类药品发布新标签要求
2016.03.25
3月22日FDA宣布要求速释阿片类止痛药品包含关于误用、滥用、成瘾、过量和死亡风险的新的黑框警告的标签变更。更新后的标签说明澄清了速释阿片类药品仅应在其它药品不耐受或不足以达到效果时使用。这项变更是FDA彻底审视其阿片类药品监管和重点在扭转阿片类滥用流行的政策的更广泛计划的一...
|