|
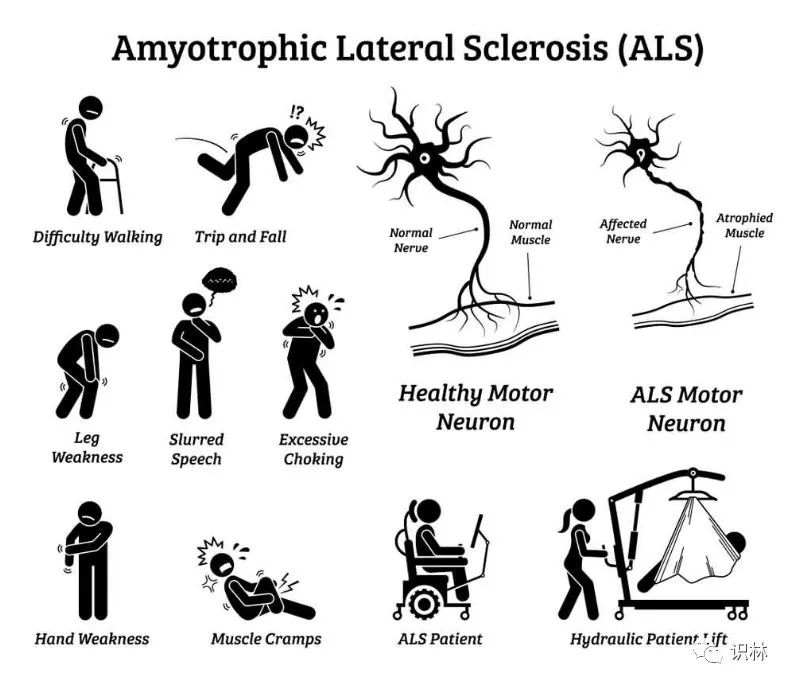
Amylyx 肌萎缩侧索硬化症治疗药将第二次上专家会,似...
2022.09.07
美国 FDA 于上周发布了关于明日(2022 年 9 月 7 日)将进行的针对 Amylyx 制药公司的实验性肌萎缩侧索硬化症(ALS)药第二次专家咨询委员会的会前资料,显示 FDA 对药物的评价并不乐观。
FDA 在会前资料中虽然承认 ALS 治疗药是“迫切需要的”,并提供了 FDA 以前对该疾...
|

|
JAMA研究发现抗癌药物临床试验数据公开仍旧艰难
2022.09.07
监管机构和临床医生是否批准和使用新药通常取决于关键临床试验的结果。对于大多数新药,药品申请方推动了支持该药物的早期证据基础,但这一过程的促进需要提高全球医疗系统的可及性。至少在药品上市后数据进一步完善之前,早期临床试验的数据仍然是安全性和疗效评估的核心。2021年5月,WHO...
|

|
诺华重磅心力衰竭药诺欣妥涉嫌侵犯共晶专利遭起诉
2022.09.06
诺华的重磅心力衰竭药物 Entresto 日前受到两所大学的联合起诉,被指侵犯了密歇根大学和南佛罗里达大学的一项共晶专利。两所大学正在寻求陪审团审判和损害赔偿,以补偿专利侵权。
Entresto(中文商品名:诺欣妥)是沙库巴曲和缬沙坦的组合,去年在全球创下了 35.5 亿美元的销售额...
|

|
国际药政每周概要:FDA和欧盟相继批准不同版本的二价...
2022.09.06
【CMC与仿制药】
08.30 【FDA】为优化吸收配制药品:阐明无定形固体分散体
【注册、审评、审批】
09.01 【EMA】欧盟建议批准的首个适应性 COVID-19 加强疫苗
09.02 【FDA】冠状病毒(COVID-19)更新:FDA 批准 Moderna、Pfizer-BioNTech 二价 COVID-19 疫苗作...
|

|
IPEM 课程 生物产品CMC的生命周期策略:分析方法、...
2022.09.05
分析方法在生物制药和质量控制上的应用
讲师:郭允籣
时间:9月17-18日上午
地点:苏州
老师简介
郭允籣女士,现任信达生物制药集团全球R&D运营负责人。曾先后在美国Amgen、Abbott和Genzyme等生物制药公司从事产品开发并担任产品负责人及CMC负责人,有25年以上从事蛋白...
|

|
国内药政每周导读:药品“网销”监管落地,说明书药学...
2022.09.05
【CMC与仿制药】
8.29,【CDE】关于公开征求《溶液型滴眼剂仿制药药学研究技术指导原则(征求意见稿)》意见的通知
8.30,【CDE】关于公开征求《化学仿制药参比制剂目录(第六十二批)》(征求意见稿)意见的通知
8.31,【药典会】关于奥美拉唑等多个国家药品标准草案的公...
|

|
【周末杂谈】抓眼形容词的滥用
2022.09.04
从美国NIH科研项目申请书看生命科学界近年来用词的变迁
给年轻人改简历时,改动最多处就是删去形容词和副词。例如:一位软件工程师说自己非常熟练C++编程。非常和熟练两个词都应删去。取而代之的可以是,例如:“有5年约5万行的C++编程经验”。
国立健康研究院(NIH)是美国生命...
|

|
【识林新功能】 个人学习数据展示:点点足迹,滴滴汗...
2022.09.03
带着功能关键词,先来视频里一探究竟吧!
【日学习数据】本周一vs上周一,日积跬步
【周学习数据】本周vs上周,持之以恒
【月学习数据】本月汇总,将至千里
【每月登录】好好学习,天天向上
【月度排名】制药行业最好学,你追我赶
link=13px 【识林】识林使用:学习数据...
|

|
【识林翻译】欧盟GMP附录1中译,NMPA临床药物GMP英译...
2022.09.03
识林里,中外法规指南浩如烟海。识林用户的第一步,往往是从本职工作出发,检索、阅读和使用。即使没有出口业务的用户,也可开展系统性学习,遍读各国法规,形成对重要知识点的深度认知。为帮助用户跨越语言关,加深理解,识林翻译团队(也包括向导)将努力为识林企业用户提供法规指南...
|

|
研究显示 FDA 加速审批计划整体达到预期目标
2022.09.02
1992年,为了应对艾滋病的流行,FDA制定了加速审批(accelerated approval)政策。2012年,加速批准途径被美国国会纳入法规,用于“加速”治疗危重疾病的药物进入临床。
在快速批准中,药物是否通过审批通常是以替代终点作为依据,FDA将其描述为“一种标记物,例如实验室测量值、放射...
|

|
研究表明制药商没有动力完成加速审批的确证性试验
2022.09.02
根据最新发表在 Health Affairs 上的一项分析研究1显示,通过美国 FDA 加速审批路径批准的抗癌药物在经过确证性试验证明有临床获益后并未获得价格上涨。
研究作者包括布鲁金斯学会的 Richard Frank,哈佛大学的 Mahnum Shahzad,以及宾夕法尼亚大学的 Ezekiel Emanuel。研究...
|

|
多家药企敦促美最高法重审CAR-T专利侵权案,吉利德表...
2022.09.01
7月18日,Amgen、GSK和Regenxbio等多家制药公司和研究机构向美国最高法院(SCOTUS)提交了“法庭之友”意见书(amici briefs),称联邦巡回法院最近的一项关于CAR-T专利侵权诉讼的裁决违背了先例,可能会颠覆整个生物制药创新的生态系统,并表示支持百时美施贵宝公司(BMS)对吉利德“19...
|
|
FDA 授权针对新冠奥密克戎变种的加强疫苗,尚无新的...
2022.09.01
美国 FDA 于 8 月 31 日宣布授权 Moderna 和辉瑞的针对新冠原始毒株和奥密克戎变种的二价 mRNA 疫苗加强针。辉瑞及其合作伙伴 BioNTech 的二价加强针被授权用于 12 岁及以上人群,Moderna 的被授权用于 18 岁及以上人群。
新加强疫苗的开打仍需等待美国疾病控制和预防中心(...
|

|
人类面临病原体的灾难性威胁,制定大流行病国际条约迫...
2022.08.31
为什么说“人们正面临病原体所构成的灾难性威胁”,我们可以联想一下席卷全球绝大部分国家的新冠疫情,可以说任何一个人都无法独善其身!疫情这三年,无论是对全球人们而言、还是对各国国家而言,都是一场十足的阻击战、攻坚战,与此同时,它也是一场持久战、消耗战。然而,世界目前所经受...
|

|
EMA公布业界对ICH Q14和Q2 分析方法开发和验证指南...
2022.08.31
上周,欧洲药品管理局(EMA)公布了关于 ICH Q14《分析方法开发》和Q2(R2)《分析方法验证》的反馈意见概述。制药行业团体普遍对两份指南表示赞扬,但对于如何在监管申报中沟通有关分析方法的增强知识以及小公司是否拥有必需的资源投资增强方法提出了质疑。
其他意见还包括对分析方...
|

|
【全文翻译】FDA 2021 财年药品质量状况报告
2022.08.30
美国 FDA 药品质量办公室(OPQ)于 8 月 25 日发布 2021 财年《药品质量状况》报告,这是 OPQ 连续第四年发布这一报告(前三年的年报全文翻译点击相应年份阅览:2020 年;2019 年;2018 年),“向美国消费者和患者提供了表征药物和工厂质量的关键数据”。识林对报告内容做...
|

|
国际药政每周概要:欧盟GMP无菌附录,FDA 2021财年质...
2022.08.30
【GMP与检查】
08.25 【双语版】欧盟 GMP 附录1 无菌药品生产 定稿
【CMC与仿制药】
【注册、审评、审批】
【创新研发与临床】
【监管综合】
08.25 【FDA】2021财年药品质量状况报告
08.23 【WHO】中国疫苗监管机构达到 WHO 新级别以确保安全性,质量和有...
|

|
国内药政每周导读:我国疫苗监管通过WHO评估,药典委2...
2022.08.29
【CMC与仿制药】
8.25,【药典委】关于做好2022年度国家药品标准提高(第二批)工作的通知
8.26,【NMPA】关于发布仿制药参比制剂目录(第五十七批)的通告(2022年第38号)
【注册,审评,审批】
8.26,【黑龙江省】公开征求《关于药品上市后场地变更实施办法》(征求意...
|
|
合规专家解读 FDA 远程监管评估指南
2022.08.29
新冠肺炎疫情对美国FDA的检查计划造成了前所未有的破坏。由于疫情而暂停了绝大多数检查活动,FDA被迫试行新的检查计划,包括远程交互式评估,更多地使用21 USC 374(a)(4)下的记录请求(通常称为704项请求),以及更多地依赖互信协议下的其他卫生当局检查。
2022年7月22日,FDA发...
|

|
【周末杂谈】对欧盟 GMP 无菌附录的关注
2022.08.28
GMP不仅是监管要求,更是良好实践
这周的识林资讯有两篇点击量异常,一是周一关于印度太阳药业数据造假(4000+),二是周五关于欧盟GMP无菌附录(10000+)。对于日常点击量仅在1000上下的识林资讯,读者对这两篇的关注,让人喜忧参半。
距离2015年国内外药监局开始严查我国药业数...
|