
|
FDA将关闭蛋白质类产品的NDA、ANDA途径
2016.03.29
2016年3月11日FDA发布题为《2009生物制品价格竞争与创新法案“认定为(BLA)许可”条款的实施》的指南草案。2020年3月23日,大概4年后,按照NDA途径获批的蛋白质类产品将失去FD&CA 505途径赋予的专营权。截至该日期,按照NDA途径申请的蛋白质类产品,如果仍未获批,将会失效。对于蛋白质...
|
|
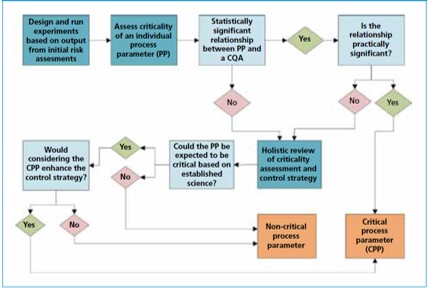
持续工艺确证中评估关键工艺参数的统计学方法
2016.03.28
在药品制造中,确保工艺处于受控状态并被确证是对公众健康和监管机构都是非常重要的因素。为此,持续工艺确证(CPV)被定义为常规商业化制造工艺的不断监测以确保在性能确认后持续在受控状态运行。这是2011年FDA指南中描述的工艺验证的生命周期方法的组成部分。此外,在2015年,许多其它监...
|

|
FDA发布阿片类仿制产品滥用遏制指南草案
2016.03.26
3月25日FDA发布《行业指南草案 –仿制固体口服阿片类药品的滥用遏制评价一般原则》,随着指南草案的发布关于滥用遏制仿制产品的一些问题变得更加清晰。指南草案描述了仿制药申请人在寻求参照药品(RLD)在标签中具有滥用遏制属性描述的阿片类产品的批准时应开展的实验类型(可比性体外研...
|

|
FDA对速释阿片类药品发布新标签要求
2016.03.25
3月22日FDA宣布要求速释阿片类止痛药品包含关于误用、滥用、成瘾、过量和死亡风险的新的黑框警告的标签变更。更新后的标签说明澄清了速释阿片类药品仅应在其它药品不耐受或不足以达到效果时使用。这项变更是FDA彻底审视其阿片类药品监管和重点在扭转阿片类滥用流行的政策的更广泛计划的一...
|

|
FDA更新突破性治疗认定计划推出初步请求建议表
2016.03.24
FDA的突破性治疗认定(BTD)计划已经被大家一致认为是受欢迎的计划。申办人在短短4年中提交了超过330份突破性治疗认定请求(BTDR),希望从FDA获得额外支持、缩短审评时间,给投资人以FDA顺利地查看他们的初步临床证据的信号。也许是为了响应该计划的流行,FDA开始实施一项新的程序,被称...
|

|
FDA 监管事务办公室检查项目整合计划正在酝酿巨大变...
2016.03.23
编者按:本篇文章虽然主要是FDA器械和放射健康中心(CDRH)人员对项目整合计划就器械监管方面的一些评论,但药品的监管也是一样的。文中首次较为明确的指出时间限,FDA官方虽然还没有正式宣布项目整合计划具体产品监管区域划分的细节,但这项变革会显著的改变一直以来的FDA检查模式。
...
|
|
FDA仿制药办公室更新部分组织机构图
2016.03.22
3月22日仿制药办公室(OGD)在FDA官网更新其组织机构图,但试图在大多数OGD的办公室和部门中找出许多OGD人员的职位和部门仍然很困难,即使你知道他们的名字、在OGD的职位,仍不容易辨识。
OGD似乎已经明确表明,他们不希望你能够与太多人有沟通。OGD发布了一份项目管理处(DPM)成员的...
|

|
GDUFA完全回应函与信息请求签发的效率思考
2016.03.21
今年2月是自GDUFA实施以来单月发布完全回应函(CRL)第三高(129封)的月份。之前最高的月份是2015财年7月的134封和2013财年11月的130封。随着审评机器的加速,难道会有人期待着CRL数量每个月稳定增长吗?可能不会!如果信息请求(IR)与易更正缺陷(ECD)持续保持增长,那么CRL的数量可能...
|

|
FDA对ANDA电子提交备案问题的处理引发关注
2016.03.20
仿制药企业过去抱怨GDUFA目标函,目标函商定了更多关于完全回应函(CRL)的目标还不是面向审评批准的清晰举措。GDUFA I已经实施3年,现在企业认为自己得到的和FDA已经采纳的内容似乎都有了更好的理解,尽管除了在目标函中的直接文字之外,政策正在推动申请朝向批准前进。
现在我们来关...
|

|
CFDA发布普通口服固体制剂参比制剂选择和确定指导原则
2016.03.19
2016年3月18日,CFDA的2016年第61号通告发布了《普通口服固体制剂参比制剂选择和确定指导原则》《普通口服固体制剂溶出曲线测定与比较指导原则》《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》。
与2015年10月30日的文件公布的三篇征求意见稿相...
|

|
Zarxio获批一周年:美国生物类似药市场仍有不确定性
2016.03.15
自Amgen公司的Neupogen(filgastrim)的生物类似药— Sandoz公司的Zarxio成为首个在FDA获批的生物类似药已经过去一年多的时间。Zarxio由诺华公司的子公司于去年9月上市销售,仍是获得FDA许可的唯一的生物类似药。
尽管现在已有其它一些申请已通过专用的351(k)生物类似药途径递交,但...
|

|
FDA发布ANDA审评优先级MaPP修订稿
2016.03.12
3月11日FDA发布《MaPP5240.3 原始ANDA、增补和补充审评的优先级》修订稿。MaPP(政策和流程手册)是FDA的内部政策和程序,指导FDA内部工作。这篇MaPP的主要内容是简单易懂的,但有几个问题可能需要进一步澄清。
新修订的MaPP概述了加速审评过程的历史,但没有回溯到非常早的仿制药办公...
|

|
欧洲药品管理局4月1日起调整申请费
2016.03.11
收费预计增加0.2%
欧洲药品管理局(EMA)提醒申请人和上市许可持有人对除药物警戒程序之外的所有申请调整收费,将于2016年4月1日(周五)生效。
EMA每年于4月1日按照过去一年中的欧盟(EU)通货膨胀比率调整其收费。欧盟委员会目前正在通过一项法规,按照2015年通货膨胀率支付给EM...
|

|
FDA更新初步儿科研究计划指南
2016.03.10
3月8日FDA发布《初步儿科研究计划和增补儿科研究计划的递交内容和流程》修订版指南草案。题目非常拗口,但如果你计划根据PREA(儿科研究公平法案)提交NDA,这一指南非常重要。如果拥有有效专利时同时获得6个月儿科专营权,企业当然希望获得在任何已有的专营权的基础上额外6个月的延长和额...
|
|
复杂仿制药 – 摆在FDA面前的巨大问题
2016.03.07
我们在之前一篇资讯中提到FDA前副局长Scott Gottlieb医师在GPhA年会上组织了一个三人专家会,会上讨论了对复杂药品的长审评时间问题,在这篇资讯中来看一下具体的讨论。
在小组讨论会上,Scott Gottlieb首先提出这一话题,是否应为复杂仿制药制定另外一种批准过程,从而让FDA阅览一些...
|

|
EMA发布临床数据公布政策详细指南
2016.03.05
3月3日欧洲药品管理局(EMA)向制药企业发布关于遵照其临床数据公布政策要求的细节指南。EMA临床数据公布开创性政策于2015年1月1日生效,并适用于所有在此日期或之后提交的上市许可申请中包含的临床报告。首例报告目前预测将于2016年9月公开可得。
EMA代理执行主任Noël Wathion表示,...
|

|
ANDA目标行动日期 – FDA能否满足企业期望?
2016.03.04
目标行动日期(TAD)是GDUFA的附加产品,是仿制药办公室(OGD)提出并制定以增加审评过程透明度,帮助企业预测何时能得知OGD对GDUFA第三年前的ANDA提交采取行动。如仿制药办公室主任“Cook”Uhl博士所说,TAD本质上只是期望。随着TAD项目及其任务的启动,企业已经明白这一事实。需要明确的...
|

|
FDA 2016财年2月ANDA批准数据
2016.03.03
更新:
原始ANDA的批准和接收是OGD必须平衡的阴阳面,但OGD仅对批准具有控制权。2月共接收62件原始ANDA,是2016财年提交量第二高的月份。这与12月180件的提交量相比相形见绌,但仍表明一个事实,今年OGD可期待比去年更多的申请提交。
到目前为止,本财年OGD平均每月接收71.4件ANDA...
|
|
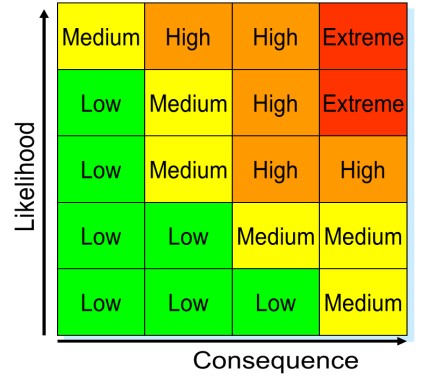
FDA药品质量办公室对原料药审评采用风险分级模型
2016.03.01
2015年11月的GPhA秋季会议上,FDA药品质量办公室(OPQ)新药产品办公室(ONDP)生命周期处代理处长Deborah Johnson讨论了OPQ如何对原料药审评适用ANDA风险分级模型。
首先检查起始物料
Johnson解释了她的部门如何将故障模式、影响及危害性分析(FMECA)模型的严重程度、分辨率和发生...
|
|
FDA加强对印度药监人员的培训
2016.02.29
最近在印度两个城市艾哈迈达巴德和班加罗尔,印度和FDA官员举办针对约200名印度监管者的培训,其中大多数是代表中央药品标准控制机构(CDSCO)和一些州药品控制机构的新检查员。这次培训是两国监管机构增长知识和能力的努力的一部分。
印度是美国药品的主要供应国之一,FDA近几年一直特...
|