
|
阿尔茨海默药被 FDA 专家会彻底否决
2020.11.07
编者按: 在半小时前刚刚结束、长达5小时的 FDA 专家委员会上,11 位专家对 Biogen 申报的、治疗阿尔茨海默的单抗新药,提出了尖锐的质疑,矛头直指 FDA 的操守,结果惨不忍睹。
link=13px 【FDA】阿尔茨海默药专家会 2020.11.06
截至发稿的半小时前,美国 FDA ...
|

|
FDA 开始审查加速审批路径,关注确证性试验和迅速撤...
2020.11.06
美国 FDA 正在认真审查“加速审批”路径,重点关注如何更好地确保及时完成确证性试验,以及如何将不符合证据标准的产品迅速撤市。
关于审查加速审批问题的想法一直广受关注,在最近的预防政策/癌症研究之友生物制药大会上得到了 FDA 高级官员的证实。新药办公室主任 Peter Stein...
|
|
欧洲药品管理局将不会为新冠候选疫苗设定最低保护效力...
2020.11.06
根据路透社消息,欧洲药品管理局(EMA)于昨日表示,在考虑批准潜在的 COVID-19 疫苗时,不会设定最低保护效力标准,这与美国 FDA 目前采取的做法不同。
EMA 在一封电子邮件中表示,人体研究需要证明令人信服的保护效力水平,但是一个疫苗是否被认为是可接受的将根据所有关于安全...
|

|
FDA 正在制定交互式远程视频 GMP 评估指南
2020.11.05
美国 FDA 药品质量政策办公室副主任 Brian Hasselbalch 表示,FDA 正在准备制定关于“使用交互式视频或其它类型的交互式工具和技术进行远程 GMP 评估”的 COVID-19 指南。
FDA 在采用远程视频虚拟检查方法方面落后于其他监管机构,包括欧洲药品管理局(EMA)和英国药品与医...
|

|
瑞德西韦带来的优先审评券:烫手山芋?
2020.11.04
吉利德(Gilead)公司的 Veklury(瑞德西韦)于 10 月 23 日获得美国 FDA 正式批准用于某些新冠住院患者的治疗,与批准同时发出的还有一张“重大威胁医疗对策优先审评券”,该审评券旨在为某些治疗、预防来自特定化学、生物、放射和核威胁伤害的医药产品提供额外激励措施。【FDA ...
|

|
FDA 紧急使用授权程序正逐步改善,应更加透明
2020.11.04
美国 FDA 从早期 COVID-19 紧急使用授权(EUA)中吸取的经验教训可能会大大提高公众对未来治疗药 EUA 或疫苗 EUA 以及监管程序本身的信任。美国达特茅斯学院政府学系研究药物监管政策的 Herschel Nachlis 在卫生事务博客上发文1,总结了从 FDA 康复期血浆 EUA、COVID-19 ...
|
|
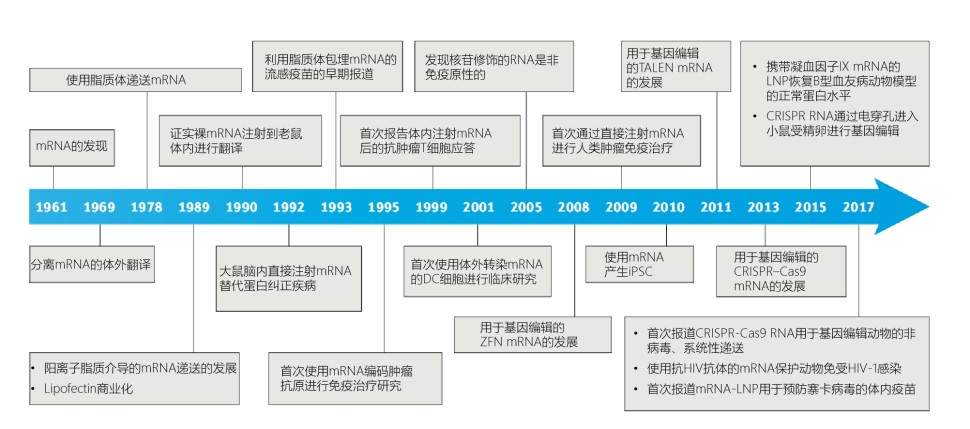
从新冠候选疫苗 BNT162b 看 mRNA 疫苗
2020.11.03
欧盟药品管理局(EMA)于10月6日宣布,基于BNT162b2的非临床和早期临床初步结果,对辉瑞/Biontech的候选新冠疫苗展开滚动审评,这是EMA第2个开展滚动审评的新冠疫苗,上一个是阿斯利康与牛津大学合作开发的AZD1222疫苗。CHMP已开始审评关于疫苗的非临床实验数据1。辉瑞之前曾表示最早10月...
|

|
一个影响重大的仿制药诉讼案例:标签剔除可能构成专利...
2020.11.03
标签剔除(carve-out),在美国的仿制药申办人使用“小八条”声明从拟议产品标签中删除橙皮书中对给定参照上市药品(RLD)列出的由使用方法专利保护的任何适应症或其它内容,以在不侵犯未到期专利权的情况下让自己的仿制药顺利获批上市。这是自 1984 年 Hatch-Waxman 修正案颁布以来...
|

|
【一周回顾】2020.10.26-11.01
2020.11.02
药审中心征求关于药品审评审批信息公开管理办法的意见。FDA 发布仿制药申报中使用的参照药品定稿指南;公布限制进口采购的基本药物和关键 API 清单;FDA 研究人员发布影响预测仿制药申报可能性的因素的文章;公布两封关于礼来 ImClone Systems 工厂的检查 483。欧盟发布亚硝胺杂...
|

|
英国 MHRA 发布使用真实世界证据的随机对照试验指南
2020.11.02
英国药品与医疗保健产品监管机构(MHRA)正在制定一系列关于真实世界证据的指南文件,现已发布第一篇关于在随机对照试验(RCT)中使用真实世界证据(RWD)来支持监管申报的指南。之后的系列指南将分别基于不同类型试验设计中真实世界证据的使用来给出建议和期望。
MHRA 表示,最可能考...
|

|
【质量对话】救火与防火
2020.11.01
救火是救点,防火是防面、需要基于体系
刺槐:最近听到了一个关于药品生产质量管理问题的新提法,至少对我是新的,想与你聊聊。杭州澳亚生物的董事长黄少峰,将发生药品质量问题比喻成着火:“说以前质量管理的重心是救火,今后的重心是防火,不仅不能着火,连烟都不能冒”。
编辑:...
|
|
FDA 发布需从美国工厂采购的基本药物和关键物料清单
2020.10.31
美国 FDA 于 10 月 30 日发布了一份《基本药物、医疗对策和关键物料清单》
8 月 6 日的行政令要求联邦各机构将对于“在美国生产的”产品的采购限制在“允许的最大范围内”。“在美国生产”要求“用于生产基本药物或医疗对策的关键物料”在美国生产,其中包括 API、制剂的核心...
|

|
EMA 推出亚硝胺杂质短中长期完整实施计划
2020.10.30
欧洲药品管理局(EMA)推出了完整实施计划,以减少药物被亚硝胺杂质污染的风险,并确定了短期、中期和长期的工作重点。
实施计划建立了一个框架,用于落实 2020 年 6 月 EMA 发布的《从沙坦类药物出现亚硝胺杂质事件学到的经验教训》报告的具体建议。【欧盟报告全面总结沙坦类药...
|
|
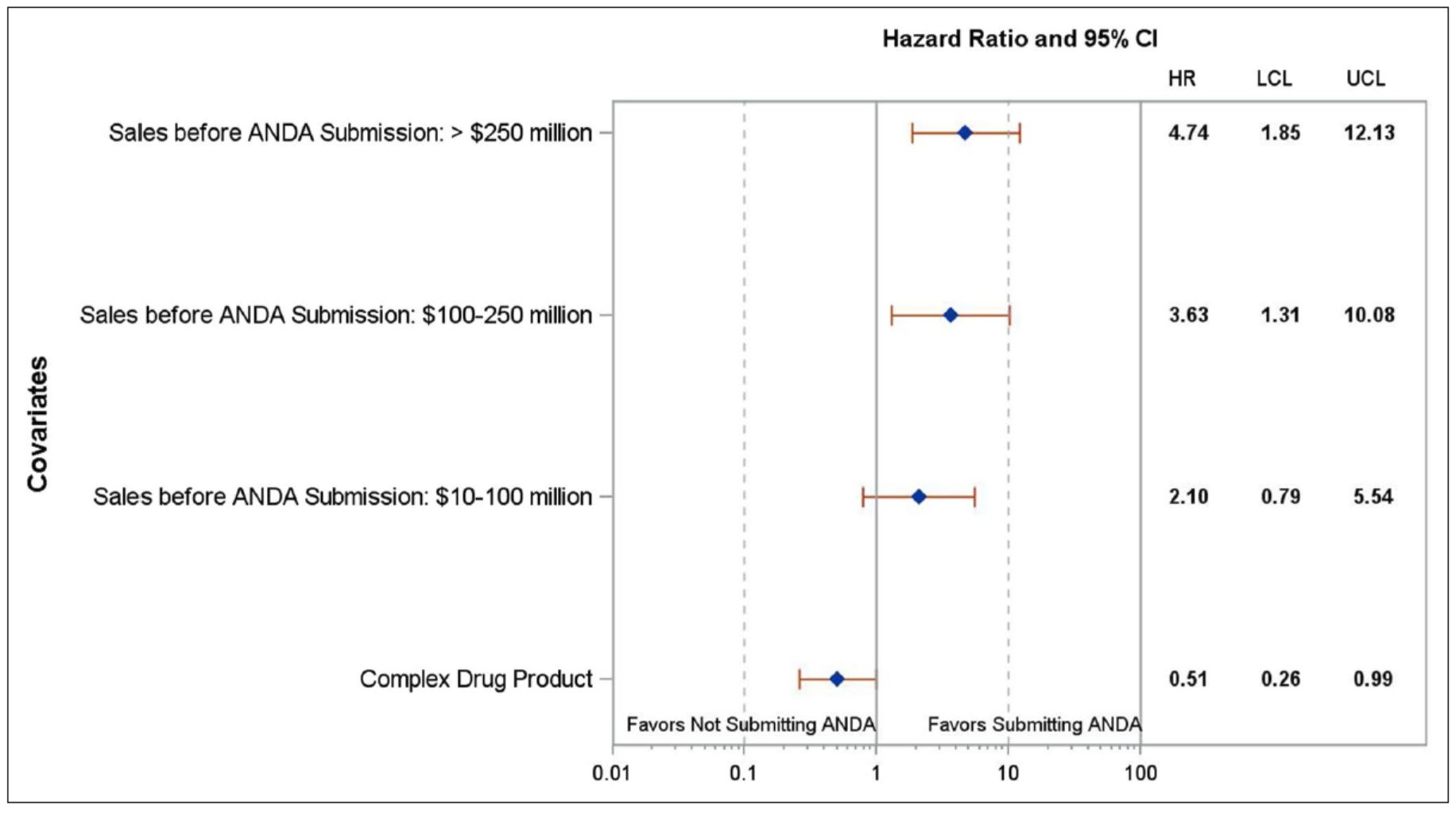
FDA 研究揭示可用来预测仿制药申报可能性的因素
2020.10.30
美国 FDA 药品审评与研究中心(CDER)研究人员正在研究药物特性、监管行动和经济因素如何影响品牌药是否有仿制药可用。
据估计,在过去十年中,仿制药已为美国节约了约 2.2 万亿美元的医疗费用。【2020 美国仿制药和生物类似药节约报告 2020/10/02】但是许多品牌药产品并未面...
|

|
FDA 仿制药申报中使用的参照药品重要指南定稿
2020.10.29
美国 FDA 于 10 月 27 日发布了《ANDA 提交中参照已获批药品》的定稿指南,定稿了 2017 年发布的指南草案,向简化新药申请人(ANDA)提供了有关如何识别参照药品(RLD)和参照标准品(reference standard)的更多详细信息,以及构成 ANDA 提交依据的基础。
FDA 在澄清如何...
|

|
EMA 新负责人:用得到且买得起的药才是有价值的药
2020.10.29
即将出任欧洲药品管理局(EMA)新负责人的 Emer Cooke 表示,“无论是基本药物还是创新药,如果不能用到患者或动物身上,那么都毫无价值。”
在 EMA 举办的庆祝成立 25 周年的网络会议上,Emer Cooke 任命后首次公开露面时讲话表示,“随着越来越多的复杂药物进入市场,我们需...
|

|
基因治疗药 Zolgensma 日本上市审批之路揭示的经验...
2020.10.28
诺华制药新型基因疗法 Zolgensma(onasemnogene abeparvovec)在 2018 年 11 月提交申请后,于今年五月在日本获批。该药用于治疗两岁及以下运动神经元存活基因1(SMN 1)出现双等位基因突变的脊髓性肌萎缩症(SMA 1)儿童患者。
该药在日本获得孤儿药认定和“sakigake”(开拓...
|
|
欧盟发布老年人药品开发考虑因素,鼓励以患者为中心的...
2020.10.27
欧洲药品管理局(EMA) 10 月 15 日发布了一份思考性文件,敦促制药商在开发药品时考虑 65 岁及以上老年患者的身体和认知能力,涵盖的考虑因素涉及选择适当的给药途径和剂型、给药频率、辅料、容器密封系统、器械和技术以及产品信息页中的使用者说明等。
根据欧洲统计局,到 205...
|

|
【一周回顾】2020.10.19-10.25
2020.10.26
药审中心发布多篇试行指南文件,包括化学药品注射剂包装系统密封性研究技术、化学仿制药口服片剂功能性刻痕设计和研究、盐酸多柔比星脂质体注射剂和注射用紫杉醇的仿制药研究技术指南。药审中心还发布关于注射剂一致性评价补充资料的通知,对于某些补充资料将不予批准。欧盟和 WHO 相...
|
|
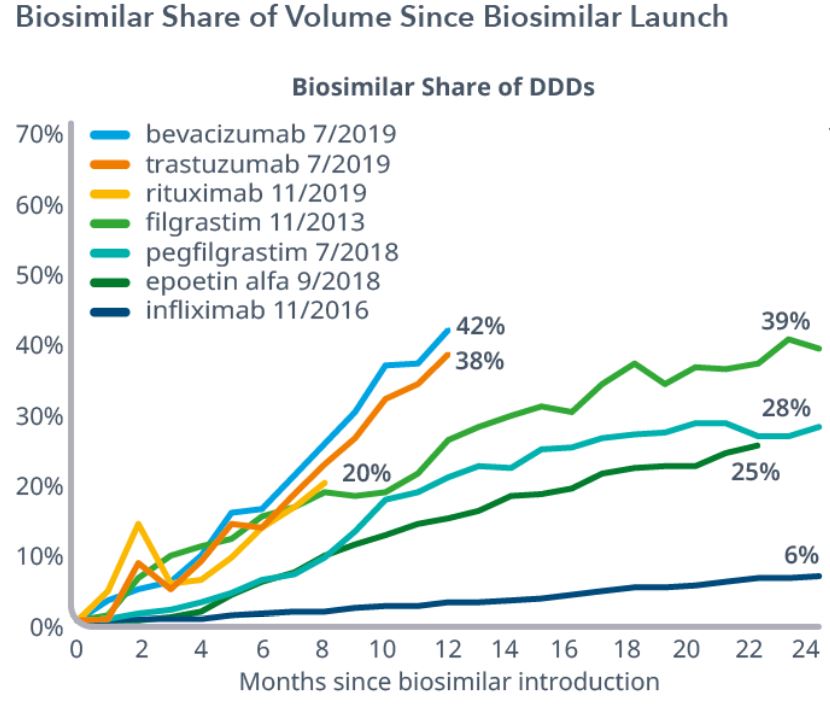
美国生物类似药市场最新预测,未来五年内将节约一千亿...
2020.10.26
根据 IQVIA 研究所发布的一份报告市场似乎正在美国起飞,有望在未来五年内减少一千亿美元的药品总支出。
根据分析报告,到目前为止在美国上市的 22 个生物类似药共拥有 20% 的市场份额,占所有生物类似药销售额的 16%。值得一提的是,Avastin(贝伐珠单抗)的首个生物类似药在...
|