
|
2017财年GDUFA收费标准公布
2016.07.27
7月26日FDA在联邦公报(FR)通告上公布了2017财年(2016年10月1日生效至2017年9月30日到期)GDUFA收费标准(https//www.federalregister.gov/articles/2016/07/27/2016-17801/generic-drug-user-fee-abbreviated-new-drug-application-prior-approval-supplement-drug-ma...
|

|
FDA公布PDUFA VI绩效目标承诺函
2016.07.26
FDA公布PDUFA VI绩效目标承诺函:2018-2022财年绩效与流程目标
正值处方药生产商付费法案(PDUFA)6个回合的首轮谈判结束一年之计,美国食品和药物管理局(FDA)于今年7月初公布了2018到2022财年的绩效与流程目标的全部细节。(文件内容详见PDUFA重新授权2018到2022财年的绩效与流程...
|

|
美国生物类似药商业上市通知条款新解释
2016.07.25
【编者按】生物类似药商业上市通知条款,即“申请人应在根据351(k)获得许可的生物制品首次商业上市之前不少于180天向参照产品持有人提供通知”,其目的是给品牌药公司留出时间决定提起什么样的专利挑战(如果有的话)。一直以来争论不绝,争论的焦点在于通知时间从何时起开始计算。生...
|

|
EMA计划修订临床I期试验指南
2016.07.24
在1月份法国临床试验导致1人死亡5人入院后,欧洲药品管理局(EMA)于7月21日宣布更新其关于首次人体(FIH)临床试验指南的计划pdf
EMA发布草案概念文件Concept paper在2016年9月30日之前向公众征询意见。概念文件列出了对指南的拟议更改,由欧盟范围内的专家小组编写,包括来自许可在...
|

|
Sandoz第三例生物类似药遭FDA拒绝
2016.07.22
诺华在7月19日早公布的第二季度财报中简短表示收到了来自美国监管机构的一些坏消息 — FDA发布完全回应函(CRL)拒绝诺华旗下Sandoz单元关于Neulasta(培非格司亭)生物类似药的上市申请。Neulasta是Amgen畅销生物制品之一,其去年的销售额为47亿美元,是长效粒细胞集落刺激因子(G-CSF...
|

|
FDA孤儿药认定请求持续飞涨
2016.07.22
FDA孤儿药认定(ODD)在过去几年中以年度30%的速度跳跃性飞涨并不少见。FDA孤儿药产品研发办公室(OOPD)主任Gayatri Rao医师指出,“2014年比前一年的数量增加了30%。而这一纪录于下一年被打破,2015年我们收到将近470件请求。而且这一步伐并没有放缓的迹象。实际上,将2016年到目前为...
|

|
GDUFA实施以来受控函数量持续上升
2016.07.21
发送到FDA仿制药办公室的受控函(CC)数量似乎自GDUFA实施以来逐年递增(请见下表)。表中的数字来源于GDUFA计划实施以来相应财年的仿制药计划行动报告。
受控函数量的增加很可能是由于《与仿制药研发相关的受控函行业指南终稿》和MaPP5200.3版本1的发布。指南终稿对受控函是什么以及...
|

|
【前沿】通过说话声音诊断疾病?
2016.07.20
在医学上关于倾听更多患者的声音的谈论已久,而现在这种说法正在按字面上的意思得以实现。学者和企业家争相根据非同寻常的数据源 — 如何说话 — 研发从躁狂发作到心脏病再到脑震荡等一切疾病的诊断和预测技术。
越来越多的证据表明,人的一系列精神和身体状况可以让你的话语含糊、...
|

|
FDA首仿180天专营权的没收风险
2016.07.18
由于关于180天专营权的没收规定涉及到公司在ANDA接收后30个月内获得批准或暂时批准,一些企业对于“要求变化”的例外情况以及30个月规定如何施行感到困惑。
企业曾询问何时或是否会付出没收代价,据了解,到现在为止尚没有一般性答案。也许FDA仿制药办公室(OGD)关于2015年12月3日FDA批...
|
|
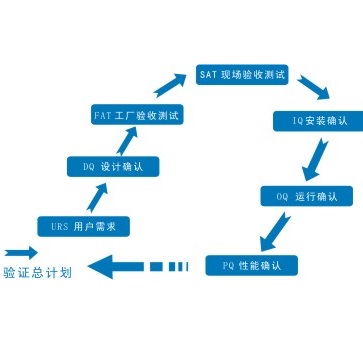
WHO的GMP验证指南及附件全面修订
2016.07.18
目前WHO生效的《GMP验证指南》是2006年的技术报告系列937 (Technical Report Series, TRS)附录4。TRS 937附录4(Annex 4)包括13个章节和7个附件(Appendix)。附件分别是:
附件1:采暖通风与空气调节系统的验证
附件2:药用水系统的验证
附件3:清洁验证
附...
|

|
欧盟药品计划加强药品价格合作
2016.07.17
欧盟理事会公布了一项计划用以分析欧洲制药企业的竞争格局提高患者对药品的可得性。文件中列出的一项关键措施是成员国当局和支付方之间密切合作,探索有助于“医药产品更高的承受能力和更好的可及性”的领域。
文件中描述了“一些成员国中越来越多的市场失效的例子”的原因是什么。包括...
|

|
ICH Q11起始物料问答指南草案进展更新
2016.07.16
人用药技术要求国际协调理事会(ICH)正在制定有关原料药生产商起始物料的问答指南,将详细说明申请人需要向监管机构就起始物料提供什么信息,并有望更好的澄清定制化学品(custom synthesised chemical)和市售化学品(commercially available chemical)之间的差异。另外,ICH Q11...
|

|
依那西普生物类似药获专家会审一致通过
2016.07.15
生物类似药批准路径对于FDA咨询委员会来说一直崎岖不平,许多咨询委员会成员表示对依赖分析相似性作为批准依据的观念感到不适应,即使FDA努力确保只有最坚实的申请才能走到专家会审阶段。但美国FDA关节炎咨询委员会7月13日对Sandoz公司的GP2015的会审在许多方面是一个分水岭,因为FDA的外...
|

|
FDA CDER主任Woodcock谈在FDA供职30周年
2016.07.15
本文整理了Janet Woodcock于2016年7月13日在“主任角 Director's Corner”的与FDA药品审评与研究中心(CDER)沟通交流办公室的Anne Rowzee的访谈。“主任角”是FDA官网网站推出的一个全新的FDA CDER主任音频播客系列。
Anne Rowzee:大家好,我是CDER沟通交流办公室的Anne Rowz...
|

|
阿达木单抗生物类似药获专家会审一致通过
2016.07.14
美国FDA关节炎咨询委员会7月12日一致投票决定支持Amgen公司对AbbVie公司的重磅生物制品Humira(阿达木单抗)的生物类似药ABP501。
在来自FDA审评人员的积极审评意见的简报之后,对关于Amgen提供的数据是否可以外推到所有Humira的获批适应症,以及关于分析表征和相似性问题展开了大量讨...
|

|
FDA对配药房配制已获批药品的指南要求
2016.07.13
美国FDA于7月7日发布两篇指南草案(第1篇,第2篇),澄清了何时允许配药房配制用于销售的药品。尽管联邦法律目前规定配药房通常不应制造已获批上市药品的仿制品,FDA制定了更具体的标准和期望,以确保在已获批药品的配药版本提供给患者之前存在真正的临床需求。
Pew慈善信托基金(一所...
|

|
FDA 2016财年6月ANDA批准数据
2016.07.12
6月FDA共批准66件ANDA,其中51件完全批准(比GDUFA第4年到目前为止的月平均批准量略低)和15件暂时批准(TA)。6月接收量回升到79件,仅次于12月180件和3月114件的接收量,排名本财年第三。本财年到目前为止共502件完全批准,144件暂时批准,665件新接收ANDA。
2016财年已拥有9个月的数...
|

|
美国国会质疑FDA保护机密信息的能力
2016.07.12
在对前FDA官员新的内幕交易指控曝光之后,美国国会正在向FDA施压,要求FDA证明对机密信息的保护。
6月24日,众议院能源与商务委员会主席Fred Upton和健康小组委员会主席Joseph Pitts致函。尽管询问的仅是食品部分,但FDA的回复适用于其监管的所有行业。
Upton和Pitt二月份的信函是...
|
|
FDA参照药品撤市后仿制药标签变更指南草案
2016.07.11
7月8日美国FDA发布《参照药品撤市后ANDA标签更新》指南草案。描述了FDA在这种情形下预期ANDA申请人如何应对以及做出何种类型的变更。
FDA在指南中明确表示,该指南对FDA仿制药拟议标签规定不具有适用性,但表示,该指南提供了FDA对ANDA申请人在特定情况下是在FDA的指导下还是在之前已获...
|

|
FDA发布两份基于下一代基因测序技术的检测的指南草案
2016.07.10
为支持总统精准医疗倡议,美国FDA于7月6日发布了两份关于发布了两份下一代测序技术(NGS)检测的指南草案,这两份指南定稿后,将为医学上检测个人基因组构成的重要差异的诊断监管提供灵活和精简的方法。
NGS技术可以扫描人体DNA,以检测可以决定一个人是否患有疾病或处于疾病的风险中的...
|