
|
国内药政每周导读:贝叶斯方法定稿,残留溶剂控制,局...
2026.01.26
【非临床和临床研究】
1.21,【CDE】关于发布《药物临床试验中应用贝叶斯外部信息借用方法的指导原则(试行)》的通告(2026年第6号)
1.23,【CDE】关于公开征求 ICH《E22:患者偏好研究的一般考虑》指导原则草案意见的通知
【CMC 药学研究】
1.22,【CDE】关于公开征...
|

|
【周末杂谈】仿制药的“仿制”二字,应慎用
2026.01.25
美国最高法院接手“瘦标签”案件,将对仿创平衡这一关键问题,做出最终决断
一年前,美国参议院两党联合提案立法《瘦标签,肥节省 (Skinny Labels, Big Savings)》(也译作“瘦身标签”),为仿制药企免于原研药企的法律起诉,提供“免死铁券”。可惜,如同先前很多试图帮助仿制药...
|

|
不是你的 CAPA 没过关......
2026.01.24
*以下内容编译自检查专家Ian Thrussell先生的分享,图片由Nano AI生成。
不是你的CAPA没过关,
是你的思路在兜圈。
其实许多483不是因为没有CAPA,
而是CAPA化了“浓妆”。
检查官并不期待完美无瑕,
他们要的是诚实、管控与责任担当。
管理层与QA挂在嘴...
|

|
美国会议员就 GLP-1药物进口问题致函三家中国公司
2026.01.23
1月14日,美国众议院资深议员Raja Krishnamoorthi宣布正式致函三家中国生物技术公司,要求其就胰高血糖素样肽-1(Glucagon-like Peptide-1,GLP-1)类药物及相关原料药(API)的生产、标签及出口情况提供详细信息。
此次信函发往Chinese Peptide Company、Hubei JXBio Biotech以及Fu...
|
|
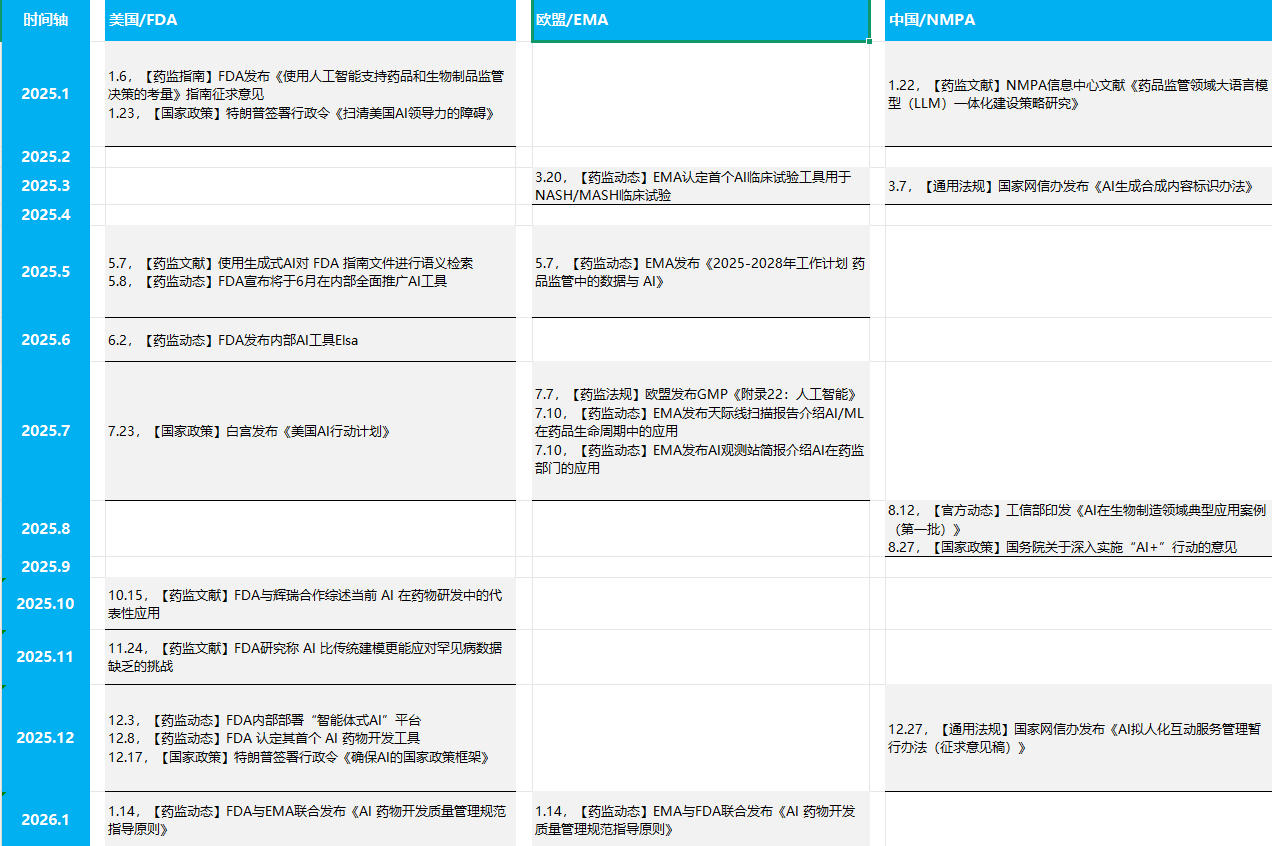
从2025看2026:制药业 AI 应用与监管的官方动态观察...
2026.01.23
当前,人工智能(AI)在全球制药领域的应用正在高速扩展,深刻影响着从药物发现、临床开发、生产质量和药物警戒等药品全生命周期各个环节。本文梳理2025年以来主要国家和地区在AI制药应用与监管方面的官方动态,内容限定于国家政策、通用法规、国家级药品监管机构发布的指南、文献及具体行动...
|
|
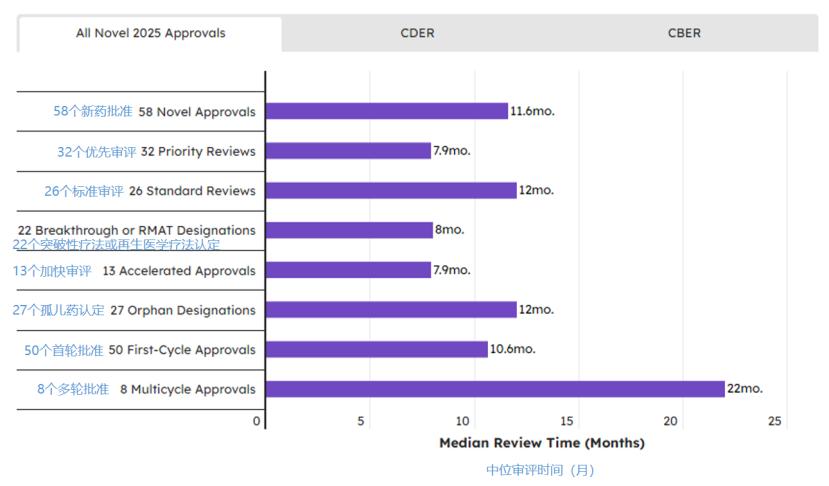
2025年 FDA 新药审评效率达标,30%被拒,CNPV 存...
2026.01.22
根据Pink Sheet数据,在动荡不安的2025年,FDA新药审评绩效表现稳健,不仅表现在数量,也体现在时间上。所有新药从提交到批准的中位时间为11.6个月,仅比2024年的11.7个月略少,与近期历史数据及PDUFA VII设定的理想时间线保持一致。仅有3个新药申请未能在目标日期前完成审评。
...
|

|
Atara 异体 T 细胞疗法再收 CRL,FDA 立场突然转...
2026.01.22
1月12日,T细胞免疫疗法前沿公司Atara Biotherapeutics宣布,FDA已针对其生物制品许可申请(BLA)发出完全回应函(CRL)。
Tabelecleucel(Tab-cel)是一种同种异体T细胞疗法,通过靶向EB病毒(EBV)感染的细胞发挥作用。支持此次申请的关键临床数据来源于一项ALLELE 3期单臂、开...
|

|
FDA“分步递交”STAR 试点折戟,至今无人过关
2026.01.21
1月13日,FDA发布“分步实时申请审评”(Split Real Time Application Review, STAR)试点项目中期评估报告,承认该项目截至目前的失败结果。
同时FDA还取消了预定于2026年3月31日召开的公开工作坊,因其认为已无必要探讨项目价值和改进措施。
STAR允许申办者分两部分提交有...
|
|
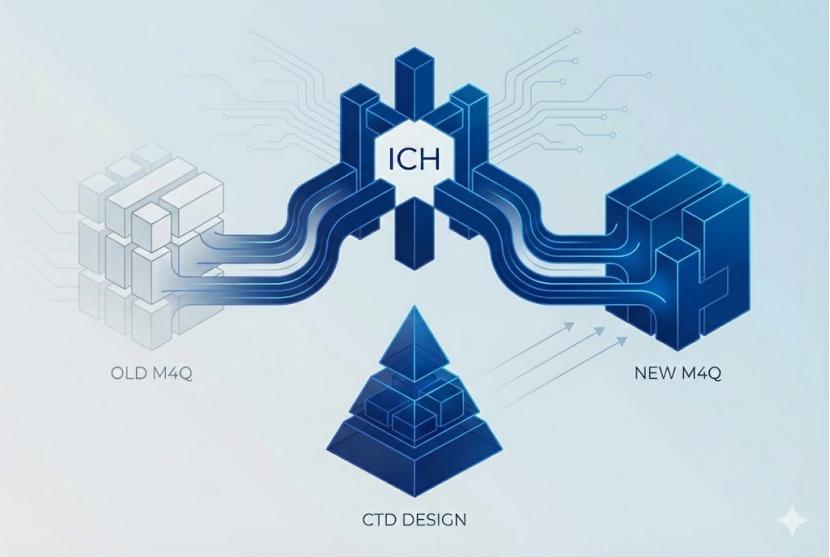
ICH 映射新旧 M4Q 目录,进一步澄清新 CTD 设计...
2026.01.21
1月15日,ICH发布一份补充性文件《M4Q(R1)与M4Q(R2)映射对照表》,将CTD质量部分(M4Q)第二修订版(R2)与现行(R1)版本之间章节结构进行映射(mapping)。
识林此前曾报道M4Q(R2)(“新CTD”)在结构上实现重大创新,为全球药品注册和生命周期管理带来新标准。其变化之大,使得早...
|
|
2026年欧盟将迎三大药品法规体系改革
2026.01.20
欧盟正持续推进一系列深远影响的药品法规改革,本文基于国外媒体报道和欧盟已公布的立法草案与政治协议,简要梳理各项立法的当前状态及政策要点,供我国出海药企参考评估未来全球业务策略。
医药改革方案:独占期,数据保护券,审评提速
欧盟医药改革方案(The Pharma Package)...
|

|
印度药业2026:审评审批优化、生物类似药趋同、GMP“...
2026.01.20
当印度出现在我国药业视野中时,通常是仿制药的强大竞争对手(也是我国大宗API的买家),或是作为FDA检查的“前车之鉴”。过去10年我国创新药成就斐然,而印度本国政策难以支撑药物创新,其作为一个药品市场也存在诸多局限,两国药业这方面的交集更少。不过,考虑到印度制药业在全球的显...
|

|
国际药政每周概要:FDA 和 EMA 联合发布 AI 原则,...
2026.01.20
【非临床与临床研究】
1.12,【FDA】药品与生物制品临床试验中贝叶斯方法学的应用
1.15,【EMA】下肢外周动脉闭塞性疾病治疗药品临床研究指南
【药学研究】
1.11,【FDA】细胞和基因疗法的灵活要求,旨在促进创新
【注册与变更】
1.13,【FDA】STAR 试点计划评估
1....
|
|
面对中国生物医药竞争,美国业界呼吁改革而非遏制
2026.01.19
美国智库国家新兴生物技术安全委员会(NSCEB)近日发布一份新报告,就FDA如何应对快速发展的生物技术创新提出近二十项政策改革建议。
此前,识林曾报导NSCEB已向国会提交了题为《科学的未来》的政策建议报告,深入剖析美国科研生态系统的结构性弊病并提出一系列策略。更早前,NSCEB于20...
|

|
创新药的中美双报
2026.01.19
一、背景
中美两国在药品注册分类和监管体系上存在差异。FDA通常将在美国首次批准的新分子实体视作“创新药”统计。而中国在2016年监管改革后建立了新的药物注册分类,强调对“全球首创新药”与“已在境外上市的进口新药”进行区分。创新化药和创新生物制品的注册分类均为1,而境外已上市...
|

|
国内药政每周导读:化药生物制品全面实施 eCTD,系列...
2026.01.19
【非临床和临床研究】
1.16,【CFDI】综合问题解答-2026 新增2个问题解答
【注册与变更】
1.15,【NMPA】关于化学药品和生物制品全面实施药品电子通用技术文档申报的公告(2026年第8号)
1.16,【CDE】常见一般性技术问题解答 新增1个问答
【经营准入】
1.14,...
|

|
【周末杂谈】对产品和法规的深入理解
2026.01.18
以两项公民情愿为例,看如何考虑药品疗效问题
企业希望药监局认同申报产品的疗效(有效性和安全性)和稳定性,批准其上市。药监局若不认同,企业可据理力争其申报材料满足法规要求,或指出以前类似的申报获得过批准。前者理论的是产品疗效和法规要求,后者理论的是药监局执法一致性。后者...
|
|
近期重点483和警告信概要,识林 AI 为您“读缺陷”
2026.01.17
识林目前收录4种检查报告,包括FDA警告信(药品警告信提供人工翻译)和483,欧盟缺陷信,以及WHO的公共检查报告。正在规划收录日本PMDA的“橙色警告信”。
此外,识林还将警告信和483分别整理成数据库,从国别、产品类型、检查官、缺陷关键词、法规条款等多个维度进行拆解。
一...
|

|
FDA 和 EMA 联合发布药物开发“GAiP”10项指导原则
2026.01.16
1月14日,FDA和EMA联合发布《人工智能药物开发质量管理规范指导原则》(Guiding Principles of Good AI Practice in Drug Development)。
因本文标题原文Good AI Practice与各类GXP用语一致,且由官方发布,因此编者按惯例暂译为“人工智能药物开发质量管理规范”,简称GAi...
|

|
欧洲药典12.3版本更新内容概要
2026.01.16
欧洲药典(Ph. Eur.)于1月7日发布第12版第3期(12.3)更新内容,识林欧洲药典专题页面收录了欧洲药典12的通则目录、每期的官方修订信息以及说明文件,“药典对比库”也推送了此次更新新闻。
现基于说明文件,将12.3的重点更新内容简介如下,供参考:
新增文本(New Texts)...
|
|
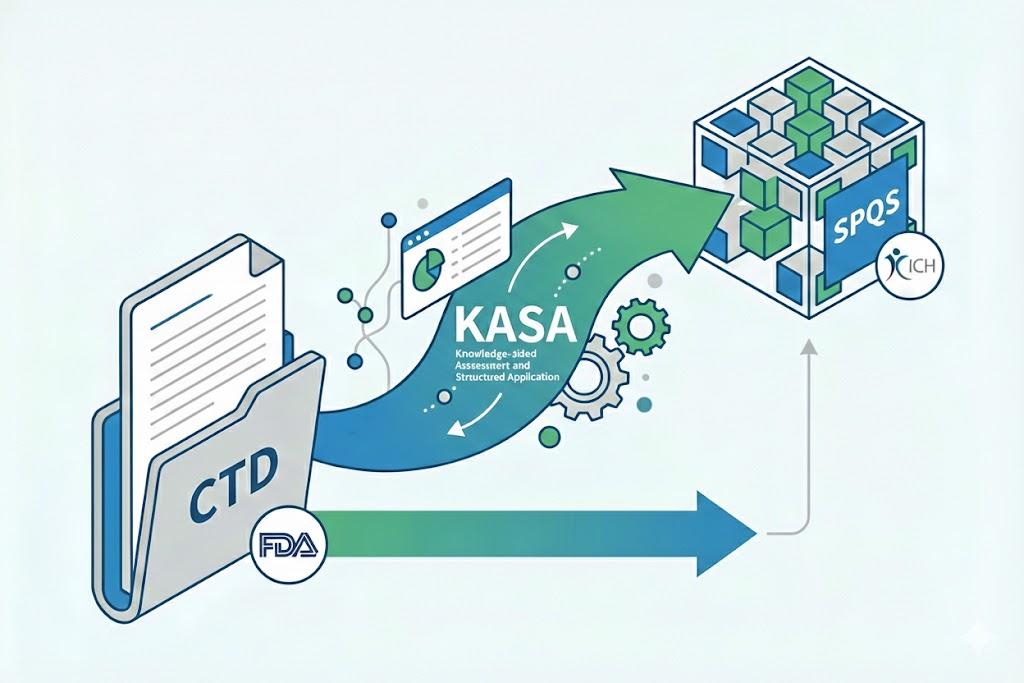
继新 CTD 之后是 SPQS,ICH 延续 FDA 药学注册...
2026.01.15
近日,ICH在其指南列表页面悄无声息地更新了一个条目,即“M16 EWG 结构化产品质量申报”(暂译,Structured Product Quality submissions,SPQS)。ICH组建了以FDA CDER药品质量办公室(OPQ)药品质量审评第1办公室(OPQA I)主任Geoffrey Wu为报告人的专家工作组,开始编制M16...
|