|
FDA 移除 GLP-1药品标签中自杀倾向风险警告
2026.01.15
1月13日,FDA发布药物安全通告,要求诺和诺德(Novo Nordisk)和礼来(Eli Lilly)在其肥胖症治疗药物的产品标签中移除关于自杀意念和行为(suicidal ideation and behavior, SI/B)的警告信息。
FDA表示,在经过一项包括对研发项目中的临床试验进行荟萃分析、哨兵系统(Sentinel ...
|

|
2026 UCSF-Stanford 监管科学创新峰会
2026.01.14
1月11日,美国加州大学旧金山分校(UCSF)和斯坦福大学联合举办了“2026监管科学创新峰会”。这是学界-政府-商界高端年度交流会,氛围轻松、求真、开诚布公,无商业气息。每年开在JP Morgan健康医疗大会的前一天,同在旧金山。
峰会
今年峰会不如去年“峰”。FDA近来变化剧烈,官员...
|

|
实时公布 CRL 后,FDA 可能考虑披露更详细的“行动...
2026.01.14
1月11日,FDA新药办公室(OND)主任Mary Thanh Hai在旧金山举行的“2026监管科学创新峰会”上表示,披露未批准药品的完全回应函(Complete Response Letter, CRL)是否有助于创新,“时间将给出答案”。但她同时指出,由于已知自己撰写的内容将被披露,审评人员需要慎重考量如何撰写...
|

|
FDA 为 CGT 提供灵活性,重申 cGMP、质量标准和验...
2026.01.13
FDA于2026年1月11日发布公告,宣布CBER在监管细胞与基因治疗产品(CGT)的化学、生产与控制(CMC)方面采取灵活性策略。
这些策略得到领导层高调背书。FDA局长Marty Makary表示:“监管灵活性必须为CGT量身定制。这些是切合实际的改革,旨在应对CGT的独特特性,并促进更多创新。”CBE...
|

|
裁员暂未干扰2025新药批准,FDA 新招450人
2026.01.13
FDA局长Marty Makary终于在填补该机构人员空缺方面取得进展。根据Pink Sheet报道,Makary在一段面向员工的视频中表示,目前有450名新员工正在入职流程中,其中40人已经开始工作。
尽管FDA未明确新员工具体岗位安排,但可供参考的是此前美政府于2025年10月停摆时,有报道称FDA在政府...
|

|
国际药政每周概要:2026年 FDA 的 CGT 指南计划,RM...
2026.01.13
【非临床与临床研究】
1.7,【PMDA】IgA 肾病药物疗效评估需考虑的要点(早期考虑)
1.9,【FDA】指南议程:CBER 计划在2026日历年发布的指南文件
【药学研究】
1.7,【EDQM】欧洲药典12.3现已发布
【注册审评与变更】
1.8,【FDA】MAPP 5017.8 Rev. 1 ...
|

|
ECA 调研无菌制剂目检,人工仍主流,AI 可期
2026.01.12
2025年9月至10月期间,欧洲合规学会(ECA)目检专家组对其成员单位开展了一项关于无菌制剂产品100%目检当前行业实践与合规性的调研。调研报告于近日发布。
调研结果显示,行业实践基本符合《EU GMP无菌附录1》(第8.30–8.33条)、美国药典(USP)和、欧洲药典(Ph. Eur.)2.9.2...
|

|
CGT 在2026年可能迎来的 FDA 指南
2026.01.12
1月9日,CBER发布了《指南议程:CBER 计划在2026日历年发布的指南文件》,罗列有望在2026年制定、修订或定稿的指南文件标题。
尽管单抗等生物制品已移交CDER,但CBER仍监管CGT,其指南计划有助于我国相关企业提前做好预案。但这份计划另一个值得关注的方面是,在特朗普所谓“十换一...
|

|
国内药政每周导读:药品受托监督落地,进口急需药品审...
2026.01.12
【CMC 药学研究】
1.5,【CDE】关于公开征求《化学仿制药参比制剂目录(第一百零二批)》(征求意见稿)意见的通知
【注册与变更】
1.7,【NMPA】关于进一步优化临床急需境外已上市药品审评审批有关事项的公告(2026年第3号)
1.9,【CDE】常见一般性技术问题解答 - 新增2...
|

|
【周末杂谈】美国生物安全法
2026.01.11
该法律覆盖面广,时间紧,直接和间接影响值得尽早关注
近来发生的一系列国际事件显示国际法和国际组织的作用已不明显,因为建立和维护国际秩序的主要力量已发生了变化。全球面临的已不仅是供应链脱钩的产业和经济问题,还包括疆界和资源主权的再划分问题。大形势趋紧的形势下,我国药业应...
|
|
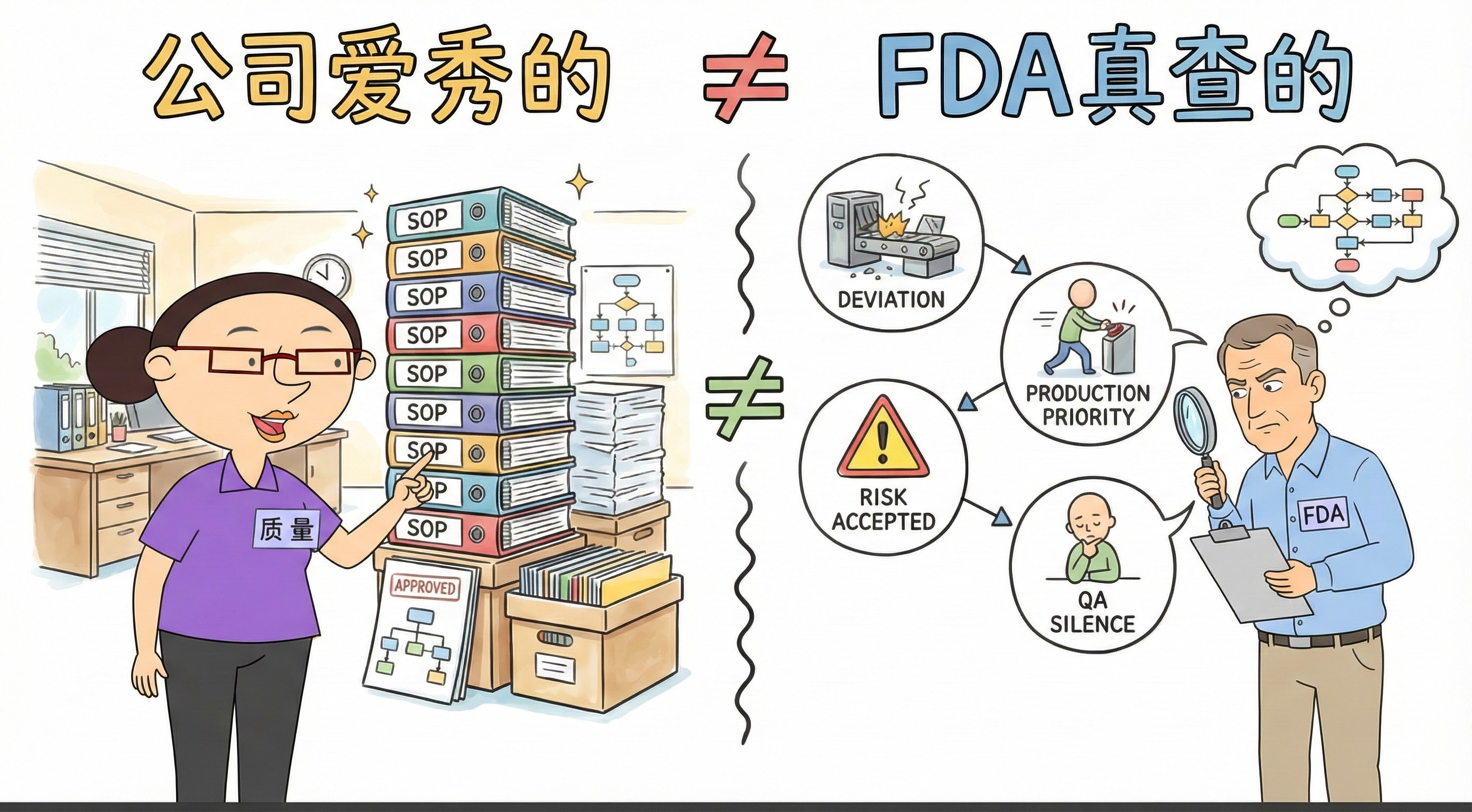
你以为 FDA 查的是...
2026.01.10
*以下内容编译自检查专家Ian Thrussell先生的分享,图片由Nano AI生成。
FDA查的不是文件,是决策。
公司爱秀的:
厚厚的SOP!
排版完美的记录!
“已批准”的流程!
FDA真查的:
为何容忍偏差?
为何生产优先?
为何接受风险?
为何质量沉默?
...
|

|
在附录22框架下,将“人在回路”AI 用于持续工艺确认
2026.01.09
近日,识林收录了一篇文献《制药行业持续工艺确认中的人在回路 AI 应用》。在制药业热切期待AI能在药物发现和临床试验领域发挥潜能之时,这篇文献聚焦于制造和GMP领域的AI应用,主题是在欧盟GMP《附录22人工智能》框架下,AI技术、持续工艺确认(Ongoing Process Verification, OP...
|

|
AI 已开始设计抗体药物,但“从头设计”尚待时日
2026.01.09
AI药物设计是近年来药物创新热点领域,在2026新年前后多家AI新药公司获得大药企和资本青睐之时,STAT发布了一篇题为《AI终于开始设计抗体药物,但何时才能革新生物医药产业?》(AI has finally started making drug-like antibodies. When will it revolutionize biopharm...
|
|
印度药监拟将止咳糖浆移出非处方药目录,应对严重污染...
2026.01.08
印度中央药品标准控制组织(CDSCO)于2025年12月29日发布一项修订草案,提议将止咳糖浆从《药品法规(1945)》附表K(Schedule K)中移除。该草案公示期为30天,面向公众征求意见。
根据现行法规,列入附表K的药品类别可在无处方情况下于零售渠道销售。附表K目前列有15类可豁免处方...
|

|
中国香港卫生署启动“1加”机制新药注册前“一对一”...
2026.01.08
近日,中国香港卫生署宣布正式启动针对“1+”机制新药注册申请的“一对一”会面咨询服务。该服务即日起接受申请,旨在通过前置咨询环节优化新药注册审批流程,进一步巩固香港作为国际医疗创新枢纽的地位。
卫生署推出的“一对一”会面咨询服务是“1+”新药注册申请前咨询服务体系的...
|

|
EMA 将通过指南落地哪些监管科学重点?
2026.01.07
2025年12月份,EMA发布了多个领域的监管工作三年滚动计划,包括非临床、方法学、生物制品、生物类似药、CHMP/CVMP(人用药/兽药审评)以及紧急工作组。计划的关键内容之一,也是业界可以直观感知到监管变革的,是其指南活动(Guidance activities)部分,即该领域正在和即将发布的指...
|

|
日本 PMDA 规划内部 AI 应用,先从运营提效起步
2026.01.07
12月8日,日本PMDA新建了“人工智能行动工作组”(AI Action WG)页面,并发布一份《PMDA 运营中 AI 应用的行动计划》,旨在系统性地导入人工智能(AI)技术,全面提升机构在药品和医疗器械领域的审查、安全监测及管理运营能力。
AI与药品监管的结合(点击阅读识林专题文章)可...
|

|
国际药政每周概要:新加坡 HSA 更新 GCP 检查等临...
2026.01.07
【非临床与临床研究】
1.2,【HSA】GCP 合规检查框架指南
【药物警戒】
12.31,【FDA】MAPP 6700.9 Rev.2 基于 FDA 不良事件报告系统的新安全信息或潜在严重风险信号的发布规定
【生产质量】
本周 483和警告信
【非临床与临床研究】
1.2,【HSA】G...
|

|
FDA 回顾加速罕见病治疗(ARC)框架下多个监管项目
2026.01.06
12月2日,FDA CDER发布了《加速罕见病治疗(ARC)计划-第三年年度报告》,系统回顾了ARC计划在2024-2025财年取得的进展。
社会发展与民众对罕见病的关注成正比。新的FDA领导层即使动荡不宁,但对于罕见病的关注和促进仍是一贯的,近期就推出“罕见病证据原则”和“合理机制路径”...
|
|
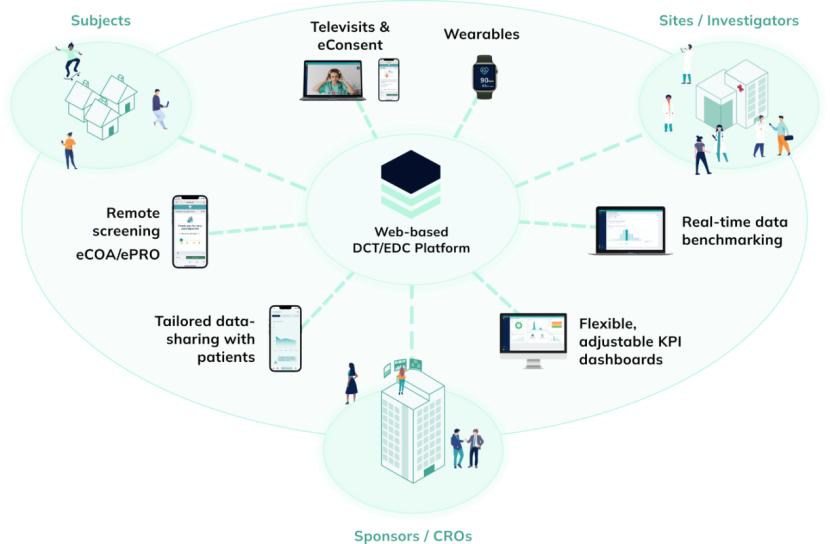
加拿大 HC 指导去中心化临床试验,监管重心是 QI
2026.01.06
加拿大卫生部(HC)在12月23日发布《关于去中心化临床试验的指南草案》,为申办者、研究者及相关各方提供技术与监管指引。
HC认识到去中心化研究更贴近参与者,有助于提升民众对试验及新疗法的可及性,并促进参与人群的多样性。原则上,HC对其监管要求与传统临床试验相同,但要求申办...
|